Immagine Credit UC San Diego.
Una proteina sfuggente che molti considerano la chiave per comprendere appieno le cause della malattia genetica del Parkinson è stata messa a fuoco molto più chiaramente.
I ricercatori che studiano le cause primarie della malattia si sono concentrati sulle mutazioni della proteina nota come leucine-rich repeat kinase 2 (LRRK2) o anche dardarina. Capire come LRRK2 interrompe il suo normale funzionamento è stato difficile a causa della mancanza di informazioni sulla struttura della proteina. Poiché LRRK2 è uno dei principali bersagli dei farmaci, gli sforzi per decifrare l’architettura di LRRK2 hanno persino incluso il lancio di campioni nello spazio come un modo per utilizzare le condizioni di microgravità per aiutare a cristallizzare i campioni di proteine, ma senza successo.
Ora, gli scienziati dell’Università della California di San Diego, utilizzando tecnologie all’avanguardia, hanno prodotto le prime visualizzazioni di LRRK2 all’interno del suo ambiente cellulare naturale e il primo modello ad alta risoluzione della proteina. Hanno sfruttato queste raffigurazioni per descrivere come LRRK2 si lega a tracce cellulari chiamate microtubuli e funge da blocco stradale per i motori che si muovono lungo queste tracce.
I risultati dello studio sono descritti in due articoli di ricerca pubblicati sulle riviste Cell e Nature.
“Questi due documenti compiono passi da gigante verso lo sviluppo di terapie più efficaci per il morbo di Parkinson, che ha un impatto su così tante vite”, ha detto il Dean Kit Pogliano, PhD, Divisione di Scienze Biologiche, Professore nella Sezione di Biologia Molecolare. “La combinazione della microscopia crioelettronica con l’imaging cellulare dal vivo consente ai ricercatori di vedere le proteine che lavorano all’interno delle cellule e di determinare più rapidamente come i potenziali farmaci influenzano la loro funzione. Ciò accelererà la scoperta di farmaci e fornirà una nuova speranza a coloro che soffrono di questa malattia debilitante “.
LRRK2: un obiettivo terapeutico chiave per la malattia di Parkinson
Conosciuto come chinasi, LRRK2 è un tipo di enzima che aggiunge tag chimici fosfato ad altre proteine, influenzandone la funzione. Le mutazioni di LRRK2 sono la causa principale delle forme ereditarie del morbo di Parkinson, ma i ricercatori non comprendono appieno come questo enzima funzioni normalmente o negli stati patologici.
Le risposte a tali domande sono state perseguite con vigore, soprattutto perché le chinasi sono uno degli obiettivi farmacologici più affermati per le terapie. Da quando il gene LRRK2 è stato clonato per la prima volta nel 2004, c’è stato un enorme sforzo dedicato a prenderlo di mira per il trattamento del Parkinson.
Susan Taylor, un’autorità di fama mondiale nello studio delle chinasi, ha riconosciuto che l’esperienza presso l’UC San Diego era ideale per affrontare questo problema. Con il supporto della Michael J. Fox Foundation, un team internazionale, che comprende ricercatori della UC San Diego, ha deciso di studiare LRRK2 utilizzando nuove tecnologie.
Un modello cellulare di LRRK2 sui microtubuli
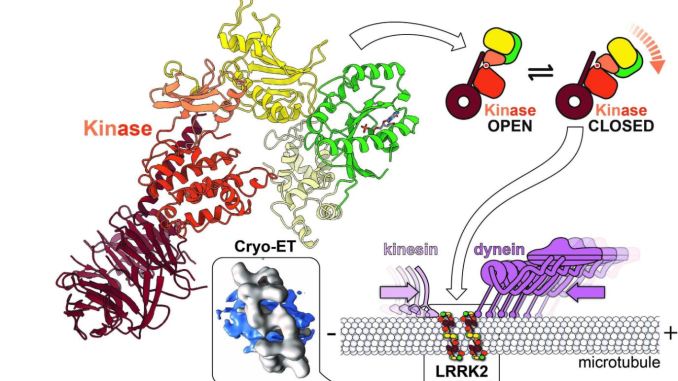
Come descritto in Cell, i ricercatori della UC San Diego guidati da Elizabeth Villa, PhD e i suoi colleghi hanno sfruttato una nuova tecnologia rivoluzionaria nota come tomografia crioelettronica (cryo-ET), una modalità di microscopia crioelettronica (cryo-EM), per visualizzare LRRK2 nel suo ambiente naturale all’interno delle cellule e descrivere la sua struttura a un livello mai visto prima.
I ricercatori della UC San Diego hanno scoperto che LRRK2 lega i microtubuli e crea blocchi stradali che fermano le macchine molecolari che guidano il trasporto cellulare del carico. Hanno anche dimostrato che alcuni farmaci che prendono di mira la chinasi di LRRK2 aumentano questo effetto, mentre altri lo riducono.
In molti casi, quando i ricercatori cercano di determinare la struttura di una proteina, iniziano isolando la proteina al di fuori delle cellule. Quando si utilizza cryo-EM, gli scienziati congelano le molecole in un sottile strato di ghiaccio, preservandone la struttura e determinando la loro struttura ad alta risoluzione. Invece, il team di Villa utilizza cellule congelate che contengono le molecole in esame, scattando foto da diverse angolazioni, un po’ come una TAC.
“Abbiamo sollevato ‘il cofano’ per guardare all’interno della cellula le molecole congelate catturate nell’atto di interagire tra loro in punti diversi della cellula”, ha detto Villa, che ha notato l’importanza di co-sviluppare gli strumenti all’avanguardia utilizzati nello studio con i notevoli sforzi di Thermo Fisher Scientific e UC San Diego nella creazione di una nuova struttura crio-EM nel campus. “Abbiamo usato fasci di elettroni e ioni come una spada laser per spazzare via parti della cellula. Al centro abbiamo lasciato una finestra che contiene le molecole che ci interessa guardare”.
I ricercatori hanno anche utilizzato la microscopia ottica per trovare le molecole all’interno delle cellule e strumenti avanzati di modellazione computazionale per sviluppare un modello integrativo ad alta risoluzione di un mutante LRRK2. I loro dati hanno rivelato che LRRK2 si lega alle autostrade cellulari, chiamate microtubuli, decorandoli in una geometria straordinariamente regolare e inaspettata, e hanno predetto che la chinasi di LRRK2 somigliava a uno stato di “overdrive” noto per verificarsi nella malattia di Parkinson.
Vedi anche: E.coli può contenere la chiave per il trattamento del Parkinson
“Questa combinazione di nuove potenti tecniche è stata applicata per la prima volta in questa ricerca e ha permesso di ottenere i primi scorci sulla struttura di un mutante LRRK2, con l’ulteriore vantaggio del suo contesto cellulare”, ha detto Villa. “Per quanto ne sappiamo, è la struttura a più alta risoluzione di una proteina umana che è stata determinata all’interno delle cellule prima di utilizzare strumenti biochimici convenzionali”.
Un progetto molecolare di LRRK2
Per capire come funziona LRRK2 a livello chimico e per progettare terapie, è necessaria una struttura a risoluzione ancora più elevata per rivelare la posizione degli atomi e il modo in cui interagiscono con potenziali farmaci. Nello studio su Nature, gli autori co-senior Samara Reck-Peterson, PhD e Andres Leschziner, PhD, hanno esaminato più da vicino la struttura e la funzione di LRRK2 e hanno collaborato con il gruppo di Villa per determinare come LRRK2 interagisce con i microtubuli.
Usando il cryo-EM, il team di Leschziner ha catturato l’immagine più dettagliata fino ad oggi della struttura di LRRK2, fino al livello atomico. Anche Stefan Knapp, Professore alla Goethe University di Francoforte, in Germania e il suo gruppo sono stati determinanti nel determinare come rendere LRRK2 trattabile per il lavoro strutturale.
Successivamente, il gruppo Leschziner ha combinato la propria struttura con quella di Villa e ha elaborato un modello che spiega come LRRK2 si lega ai microtubuli.
Ha detto Leschziner, Professore presso la UC San Diego School of Medicine e la divisione di scienze biologiche: “La nostra modellazione ha suggerito che, quando è legata ai microtubuli, la chinasi deve essere in uno stato chiuso, indicando che la forma della chinasi può regolare il legame di LRRK2 ai microtubuli. Collaborando con il laboratorio Reck-Peterson abbiamo deciso di testare direttamente questo modello “.
LRRK2 è un ostacolo per i motori molecolari
I microtubuli sono la specialità di Reck-Peterson. Lei e il suo team sono interessati ai motori molecolari che trasportano il carico lungo i microtubuli e al modo in cui i difetti in questo trasporto causano malattie neurodegenerative e dello sviluppo neurologico umano. Reck-Peterson e il suo team si sono chiesti se l’interazione di LRRK2 con i microtubuli potesse essere dannosa per le macchine molecolari che si muovono su di essi e trasportano carichi essenziali da un posto all’altro nelle cellule.
Il suo team ha scoperto che LRRK2 crea blocchi stradali che fermano queste macchine molecolari. I ricercatori hanno anche dimostrato che alcuni farmaci che prendono di mira la chinasi di LRRK2 aumentano questo effetto, mentre altri lo riducono. Sebbene Leschziner e Reck-Peterson non siano ancora sicuri se i blocchi LRRK2 giochino un ruolo nella malattia di Parkinson, le loro scoperte hanno già implicazioni per la progettazione di farmaci che agiscono inibendo LRRK2. Il loro lavoro punta alla possibilità che gli inibitori della chinasi che chiudono il dominio chinasi di LRRK2 possano portare all’effetto indesiderato di bloccare il movimento dei motori molecolari.
“Non è ancora chiaro quale sia il ruolo del legame dei microtubuli LRRK2 nella malattia di Parkinson”, ha affermato Reck-Peterson, Professore presso la UC San Diego School of Medicine e la divisione di scienze biologiche e ricercatore dell’Howard Hughes Medical Institute. “Ma quello che abbiamo ora sono modelli cellulari e molecolari, ed è ciò che è necessario per capire cosa fa LRRK2 e per mettere a punto i farmaci terapeutici che prendono di mira LRRK2”.
Co-autori dello studio pubblicatp in Cell: Reika Watanabe, Robert Buschauer, Jan Böhning, Martina Audagnotto, Tsan Wen Lu, Daniela Boassa, Susan S. Taylor ed Elizabeth Villa, UC San Diego; Keren Lasker, Università di Stanford.
Fonte: UC San Diego Health