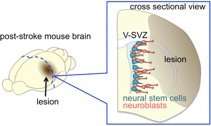
L’ ictus è una delle principali cause di disabilità cronica negli adulti e causa un pesante onere sociale ed economico in tutto il mondo. Non esistono trattamenti per ripristinare i circuiti neuronali dopo un ictus. Mentre la maggior parte dei neuroni viene generata durante lo sviluppo embrionale del cervello, nuovi neuroni continuano a essere prodotti nella zona ventricolare-subventricolare (V-SVZ) del cervello adulto.
Nell’olfatto dei roditori, i nuovi neuroni immaturi chiamati neuroblasti formano aggregati a catena che migrano al bulbo olfattivo, dove si differenziano in interneuroni. Tuttavia, nel caso della lesione cerebrale, il cervello dei mammiferi ha solo una limitata capacità di rigenerare i circuiti neuronali per il recupero funzionale. In un modello di ictus ischemico indotto bloccando transitoriamente l’arteria cerebrale media, il vaso più comunemente colpito in pazienti umani, alcuni neuroblasti derivati da V-SVZ migrano verso la lesione (Figura 1), dove maturano e si integrano con il cirrcuito neuronale. Tuttavia, il numero di questi nuovi neuroni non è sufficiente per ripristinare la funzione neuronale.
Vedi anche Le cellule staminali possono differenziarsi in neuroni e possono essere utili terapie post-ictus.
Il Dr. Kazunobu Sawamoto (Professore, Nagoya City University e NIPS) e il Dr. Naoko Kaneko (Professore associato, Università di Nagoya City) in collaborazione con il Dr. Atsushi Nambu (Professore, NIPS) e il Dr. Yasuo Kawaguchi (Professore, NIPS) hanno rivelato un nuovo meccanismo per la rigenerazione neuronale, utilizzando il modello di topo per l’ictus ischemico. Entro pochi giorni dopo l’ictus, gli astrociti, una grande popolazione di macroglia, dentro e intorno alla zona lesa si attivano, esibendo corpi cellulari più grandi, processi più spessi e comportamento proliferativo. I neuroblasti migratori devono navigare attraverso questo reticolo astrocitario per raggiungere la lesione. Utilizzando la microscopia elettronica tridimensionale e l’imaging dal vivo, il team di ricerca ha dimostrato che la migrazione dei neuroblasti è limitata dagli astrociti attivati all’interno e attorno alla lesione (Figura 2).

Nella normale migrazione legata all’olfatto, i neuroblasti secernono una proteina chiamata Slit che si lega a un recettore chiamato Robo espresso sugli astrociti. Questo legame altera la morfologia degli astrociti attivati sul sito del contatto con il neuroblasto, per allontanare la superficie degli astrociti e svuotare il percorso migratorio del neuroblasto. Tuttavia, nel caso di una lesione cerebrale, i neuroblasti migratori in realtà abbassavano la loro produzione di Slit, paralizzando la loro capacità di raggiungere la lesione per la rigenerazione funzionale. In particolare, la sovrapposizione di Slit nei neuroblasti ha permesso loro di migrare più vicino alla lesione, dove hanno maturato e rigenerato i circuiti neuronali, portando al recupero funzionale nel post- ictus nei topi (figura 3).
Questi risultati suggeriscono che le strategie progettate per aiutare i neuroni migratori a raggiungere la lesione possono migliorare le terapie basate su cellule staminali / progenitrici per le lesioni cerebrali.
Lo studio è pubblicato su Science Advances.

Fonte, Science