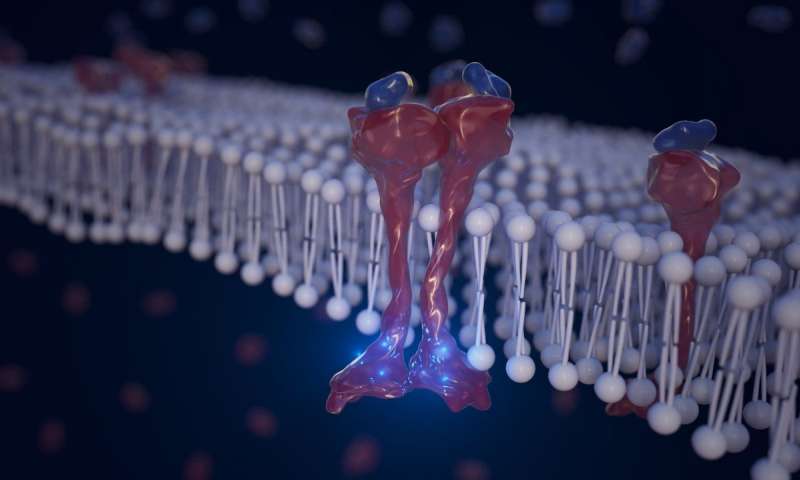
Immagine: è stato provato che un farmaco sperimentale noto come ibrutanib inibisce la funzione chinasi di ERBB4, bloccando questa cascata di eventi di segnalazione cellulare.
Negli ultimi anni, una potente suite di farmaci noti come inibitori della chinasi sono stati sviluppati per trattare il cancro e altre malattie. Gli obiettivi primari di tali farmaci comprendono una famiglia di recettori tirosin-chinasi (RTK) che sporgono dalle superfici cellulari come antenne e possono attivare percorsi correlati al cancro in praticamente tutti i tipi di cancro, quando le molecole di segnalazione si legano con essi.
In un nuovo studio, i ricercatori del Biodesign Institute dell’Arizona State University hanno utilizzato un metodo innovativo per esaminare un’ampia gamma di chinasi per l’efficacia di un farmaco. Il composto, noto come ibrutinib – un inibitore della tirosin-chinasi di Bruton (BTK) nei globuli bianchi, è stato inizialmente approvato dalla FDA nel 2013 per il trattamento della leucemia.
( Vedi anche:Scoperto meccanismo che evita l’instabilità dei telomeri nel cancro e nell’ invecchiamento).
Utilizzando una sofisticata piattaforma di microarray inventata dal Dr. Joshua LaBaer, la nuova ricerca dimostra che ibrutinib può anche colpire un membro poco studiato della famiglia RTK, noto come ERBB4, potenzialmente ostacolando la sequenza di eventi che portano alla progressione e alla crescita di altri tumori solidi. LaBaer è Direttore del Biodesign Institute e del Virginia G. Piper Center for Personalized Diagnostics.
I risultati mostrano che ibrutinib agisce come un potente inibitore della chinasi per ERBB4, limita la crescita nelle cellule tumorali umane in laboratorio e riduce le dimensioni del tumore nei topi. La sensibilità di ERBB4 a ibrutinib è simile a quella di BTK, il bersaglio originale del farmaco.
Lo studio presenta un nuovo metodo di screening per la ricerca di nuovi bersagli di farmaci come gli inibitori della chinasi e dimostra la potenziale utilità terapeutica di un farmaco esistente per mirare selettivamente a ERBB4, oltre al suo target originale BTK. (La disregolazione di BTK è associata alla proliferazione incontrollata di cellule B che portano a leucemia, linfoma e altre malattie).
“Siamo particolarmente entusiasti perché dimostramo che le proteine su questi array sono funzionalmente attive in un modo che riflette la loro attività naturale e ci consente di esaminare le loro risposte ai farmaci selettivi”, ha affermato LaBaer. “Questo ora fornisce uno strumento che ci consentirà di individuare i responder target ai farmaci o di determinare in che modo specifiche mutazioni acquisite potrebbero influenzare la risposta ai farmaci”.
I risultati della ricerca appaiono nell’edizione online della rivista Oncogene .
Un nuovo tipo di screening farmacologico
Per esplorare il comportamento sottile di ERBB4, i ricercatori usano una tecnologia nota come microarray proteico, una superficie microscopica che mostra molte proteine diverse, ciascuna in punti individuali. Quindi, un gran numero di proteine può essere esaminato simultaneamente. Utilizzando questo metodo, i ricercatori esplorano le interazioni delle proteine con altre proteine, le loro attività di legame con gli acidi nucleici come il DNA e l’RNA o con fattori rilevati nel sangue, compresa un’ampia gamma di agenti patogeni.
Convenzionalmente, la stampa di proteine su vetrini è stata un processo inefficiente e laborioso, perché le proteine sono strutture tridimensionali delicate, che devono piegarsi nel modo giusto per essere funzionali. Tuttavia, le proteine su array di proteine convenzionali sono tipicamente prodotte in sistemi non umani ed è necessario elaborare fasi di purificazione delle proteine che rendano difficile mantenere le proteine stabili nel tempo.
Nell’attuale studio, viene applicata una tecnologia rivoluzionaria nota come NAPPA (per matrice proteica programmabile di acido nucleico). Invece di stampare le proteine purificate sul diapositivo di microarray, NAPPA stampa prima DNA circolare noto come plasmidi che contengono codici genetici per proteine di interesse e quindi sintetizza le proteine target just-in-time sul posto aggiungendo l’estratto di cellule umane per più proteine naturali pieghevole. Pertanto, l’array NAPPA può fornire un sistema altamente funzionale ed efficiente per l’espressione e lo screening delle proteine.
“Puoi esprimere le proteine funzionali entro un’ora e mezza, questa è la cosa bella”, afferma la Dottoressa Femina Rauf, autrice principale del nuovo studio. “Stiamo usando il sistema del lisato umano per esprimere le proteine, quindi ci aspettiamo di vedere proteine funzionali ben piegate. Siamo particolarmente eccitati perché gli RTK sono proteine di membrana, che sono normalmente difficili da esprimere”.
Vie cellulari del cancro
Lo sviluppo di farmaci che combattono il cancro come gli inibitori della chinasi, impiega decenni a costi finanziari enormi, rendendo la prospettiva di riproporre farmaci esistenti (trovando nuovi bersagli di interesse), particolarmente attraente.
Le mutazioni negli RTK sono ritenute una forza trainante nello sviluppo del cancro. Un gruppo di quattro importanti recettori, EGFR, ERBB2, ERBB3 e ERBB4, noti come la famiglia delle tirosine chinasi del recettore ErbB, sono attivati da molecole di segnalazione note come fattori di crescita epiteliali. Queste molecole specializzate svolgono un ruolo fondamentale nello sviluppo e nella maturazione di una cellula.
I pazienti i cui tumori contengono mutazioni del recettore ERBB spesso mostrano una progressione del cancro più aggressiva e presentano esiti clinici più poveri. Per questo motivo, i recettori della tirosina-chinasi hanno un profondo interesse nella comunità medica come candidati per i farmaci che prendono di mira una varietà di tipi di cancro.
Mentre EGFR e ERBB2 sono già sfruttati come importanti bersagli terapeutici e hanno ricevuto (insieme a ERBB3), un accurato controllo, poco si sa del quarto membro della famiglia RTK: ERBB4. Questo recettore è di crescente interesse, poiché le mutazioni in ERBB4 sono state collegate in recenti studi, al melanoma e al cancro del polmone e l’espressione alterata di ERBB4 è stata osservata nel cancro al seno, nel neuroblastoma, nel cancro del colon e nel carcinoma polmonare non a piccole cellule.
Inoltre, ERBB4 può giocare un ruolo in altre malattie tra cui la sclerosi laterale amiotrofica, nonché disturbi del neurosviluppo come l’autismo e la schizofrenia.
“Nessuno ha fatto uno studio sistematico per i farmaci per ERBB4: i ricercatori tendono a concentrarsi su EGFR e ERBB2 perché sono bersagli attraenti nel campo del cancro”, afferma Rauf. “Rapporti recenti hanno trovato molte mutazioni in ERBB4, specialmente nel cancro del polmone e nel melanoma, suggerendo che questo recettore può giocare un ruolo importante nell’oncogenesi o nello sviluppo del cancro”, dice il ricercatore.
ERBB4, come i suoi membri della famiglia dei recettori della chinasi, è una proteina di membrana, con il suo componente recettore che sporge dalla superficie della cellula per catturare le molecole di segnalazione nell’ambiente extracellulare, mentre la porzione intracellulare di ERBB4 contiene un segmento chiamato dominio chinasi e residui di tirosina, un amminoacido.
Quando le molecole di segnalazione si legano con il recettore extracellulare di ERBB4, il suo dominio chinasi all’interno della cellula aggiunge fosfati ai residui di tirosina, innescando una reazione a catena di eventi di segnalazione. Il processo è noto come fosforilazione della proteina e svolge un ruolo cruciale in una miriade di eventi cellulari tra cui la progressione e la proliferazione del cancro e questo studio ha scoperto che ibrutinib può bloccare questo processo inibendo la funzione chinasi di ERBB4. (Vedi figura 1)
Indizi sul cancro
Lo studio ha immobilizzato 108 diverse protein chinasi e 30 non chinasi sulla diapositiva NAPPA, tra cui ERBB4 e altri RTK. Quando la matrice è stata esposta a ibrutinib, il farmaco si è strettamente legato a due proteine specifiche. La prima è BTK, la proteina legante per cui il farmaco è stato originariamente progettato per essere bersaglio. Sorprendentemente,ibrutinib lega anche ERBB4, con affinità simile.
Una coppia di test in vitro è stata utilizzata per confermare l’attività di ibrutinib su ERBB4. I risultati dello studio dimostrano, per la prima volta, il potere di NAPPA come una piattaforma di screening dei farmaci imparziale. Avendo stabilito ibrutinib come farmaco candidato per il target ERBB4, il passo successivo è stato testarlo in effettive impostazioni biologiche, prima nelle linee cellulari che sovraesprimevano ERBB4 e infine nei topi.
In un certo numero di linee cellulari, ibrutinib ha bloccato la proliferazione del cancro. Altre cellule, tuttavia, hanno mostrato resistenza al farmaco. Eseguendo il sequenziamento dell’RNA, il gruppo ha eliminato i modelli di espressione genica associati alla resistenza.
I risultati hanno mostrato che le cellule che esprimono alti livelli di WNT5A, un attivatore della via Wnt e bassi livelli di DKK1, un inibitore della via Wnt, erano resistenti al farmaco inibitore della chinasi. Al contrario, bassi livelli di espressione di WNT5A e DKK1 elevati erano associati alla sensibilità cellulare a ibrutinib e alla crescita cellulare ridotta, quando esposti al farmaco. Questi risultati sono in linea con recenti studi su larga scala, che forniscono indizi allettanti che una funzione del WNT5A, un oncogene noto, è di conferire resistenza a determinati farmaci.
Quando le cellule sensibili a ibrutinib che esprimono alti livelli di ERBB4 sono state trasferite ai topi, è stato dimostrato che ibrutinib riduce le dimensioni dei tumori, dimostrando un forte potenziale del farmaco nel trattamento dei tumori correlati a ERBB4.
I risultati di questo studio sono particolarmente preziosi poiché sono in corso numerosi studi clinici con l’uso di ibrutinib per il trattamento di tumori solidi. La sovraespressione di ERBB4 è stata notata in numerose malattie, tra cui il cancro al seno triplo negativo e il carcinoma ovarico. La scoperta di una firma di resistenza a ibrutinib aiuterà i medici a interpretare i loro risultati di trattamento e valutare quando è più probabile che ibrutinib abbia successo. L’uso di ibrutinib, forse in combinazione con altri farmaci che mirano a percorsi di resistenza cellulare, può aprire la strada a un nuovo trattamento contro il cancro.
Fonte: Nature