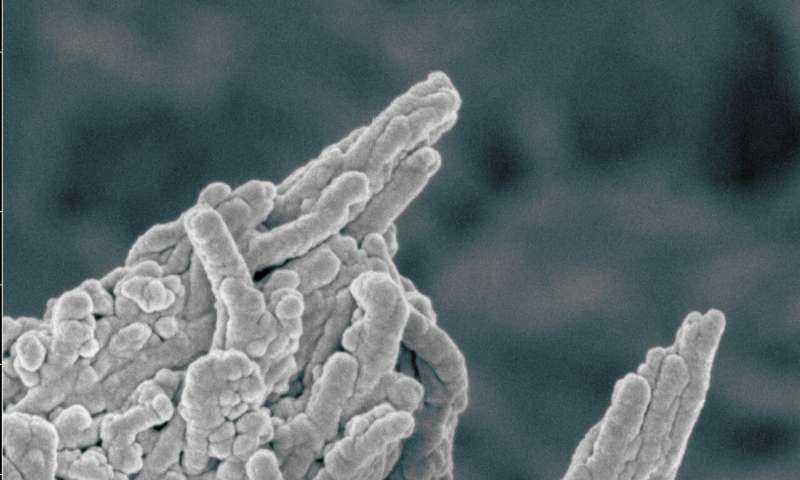
Immagine a colori dei depositi di fosfato di calcio sull’osso. Credito: Melinda Duer / Cathy Shanahan.
Un team di scienziati britannici ha identificato il meccanismo dietro la calcificazione delle arterie e ha dimostrato negli studi sugli animali, che un farmaco generico normalmente usato per curare l’acne potrebbe essere un trattamento efficace per la condizione.
Il team, guidato dall’Università di Cambridge e dal King’s College di Londra, ha scoperto che una molecola, che una volta pensava esistesse solo all’interno delle cellule allo scopo di riparare il DNA, è anche responsabile dell’indurimento delle arterie che è associato a demenza, malattie cardiache, alta pressione sanguigna e ictus.
Non esiste un trattamento attuale per la calcificazione delle arterie che è causata dall’accumulo di depositi di calcio simili alle ossa, che irrigidiscono le arterie e limitano il flusso di sangue agli organi e ai tessuti.
Supportati dai finanziamenti della British Heart Foundation, i ricercatori hanno scoperto che poly (ADP ribosio) o PAR, una molecola normalmente associata alla riparazione del DNA, guida anche la calcificazione delle arterie.
Inoltre, utilizzando ratti con malattia renale cronica, i ricercatori hanno scoperto che la minociclina, un antibiotico ampiamente prescritto, spesso usato per curare l’acne, potrebbe trattare l’indurimento delle arterie prevenendo l’accumulo di calcio nel sistema circolatorio. Lo studio, frutto di oltre un decennio di ricerca, è stato pubblicato sulla rivista Cell Reports.
“La calcificazione delle arterie avviene per tutti mentre invecchiamo ed è accelerato nei pazienti in dialisi, ma fino ad ora non sapevamo cosa controlla questo processo e quindi come trattarlo”, ha detto la Professoressa Melinda Duer dal Dipartimento di Chimica di Cambridge che ha co-diretto la ricerca come parte di una collaborazione a lungo termine con la Professoressa Cathy Shanahan del King’s College di Londra.
“Questo indurimento o biomineralizzazione, è essenziale per la produzione di ossa, ma nelle arterie è alla base di molte malattie cardiovascolari e di altre malattie associate all’invecchiamento come la demenza“, ha detto Shanahan. “Volevamo scoprire cosa scatena la formazione di cristalli di fosfato di calcio e perché sembra essere concentrata intorno al collagene e all’elastina che costituisce gran parte della parete arteriosa”.
In una ricerca precedente, Duer e Shanahan avevano dimostrato che PAR – normalmente associata alla riparazione del DNA all’interno della cellula – può di fatto esistere al di fuori della cellula ed è il motore della produzione ossea. Ciò ha portato i ricercatori a ipotizzare che PAR possa anche avere un ruolo nella biomineralizzazione. Inoltre, PARP1 e PARP2, gli enzimi che producono PAR predominanti, sono espressi in risposta al danno al DNA e allo stress ossidativo, processi che sono associati sia alla calcificazione ossea che vascolare.
“Pensavo da anni che l’indurimento delle arterie era legato al danno al DNA e che il danno al DNA è un percorso attivato da molti agenti tra cui fumo e lipidi”, ha detto Shanahan. “Quando viene attivato questo percorso, guida le patologie associate all’invecchiamento: se è presente un danno sufficiente, le arterie alla fine lo rifletteranno”.
Utilizzando la spettroscopia NMR, i ricercatori hanno scoperto che quando le cellule si stressano e muoiono, rilasciano PAR che si lega fortemente agli ioni di calcio. Una volta rilasciato, PAR inizia a lavare il calcio in goccioline più grandi che si attaccano ai componenti delle pareti delle arterie che conferiscono all’arteria la sua elasticità, dove formano cristalli ordinati e solidificano, indurendo le arterie.
“Non avremmo mai previsto che l’indurimento delle arterie fosse causato da PAR”, ha detto Duer. “Inizialmente è stata una scoperta casuale, ma l’abbiamo seguita e siamo arrivati a una potenziale terapia”.
Avendo scoperto i collegamenti tra il danno al DNA, PAR, calcificazione delle ossa e delle arterie, i ricercatori hanno quindi esaminato un modo per bloccare questa via attraverso l’uso di un inibitore di PARP.
“Dovevamo trovare una molecola esistente che fosse economica e sicura, altrimenti sarebbero passati decenni prima di sviluppare un trattamento”, ha detto Shanahan. “Se qualcosa è già stato dimostrato essere sicuro negli esseri umani, il viaggio verso lo studio clinico può essere molto più veloce”.
Lavorando insieme a Cycle Pharmaceuticals, una società con sede a Cambridge, i ricercatori hanno identificato sei molecole note che pensavano potessero inibire gli enzimi PARP. Esperimenti dettagliati con queste molecole hanno dimostrato che l’antibiotico minociclina era altamente efficace nel prevenire l’indurimento delle arterie.
“Ci sono stati 12 anni di ricerca di base per arrivare a questo punto”, ha detto Duer. “Siamo partiti senza alcuna aspettativa di trovare un potenziale trattamento – al momento non ci sono trattamenti e nessuno ci avrebbe creduto se avessimo detto a quel punto che avremmo curato l’indurimento delle arterie“.
La tecnologia è stata brevettata ed è stata concessa in licenza a Cycle Pharmaceuticals da Cambridge Enterprise, braccio della commercializzazione dell’Università. I ricercatori sperano di effettuare una sperimentazione sui nei pazienti nei prossimi 12-18 mesi.
“La calcificazione dei vasi sanguigni è un fattore di rischio ben noto per diverse malattie cardiache e circolatorie e può portare ad alta pressione sanguigna e, infine, a un infarto”, ha detto il Professor Jeremy Pearson, Direttore medico associato presso la British Heart Foundation. “Ora, i ricercatori hanno dimostrato come si verifica la calcificazione delle pareti dei vasi sanguigni e come il processo differisce dalla normale formazione ossea, così facendo sono stati in grado di identificare un potenziale trattamento per ridurre la calcificazione dei vasi sanguigni senza alcun effetto collaterale. Questo tipo di trattamento andrebbe a vantaggio di molte persone e attendiamo con impazienza i risultati delle sperimentazioni cliniche anticipate per verificare se questo farmaco è all’altezza delle sue promesse iniziali “.