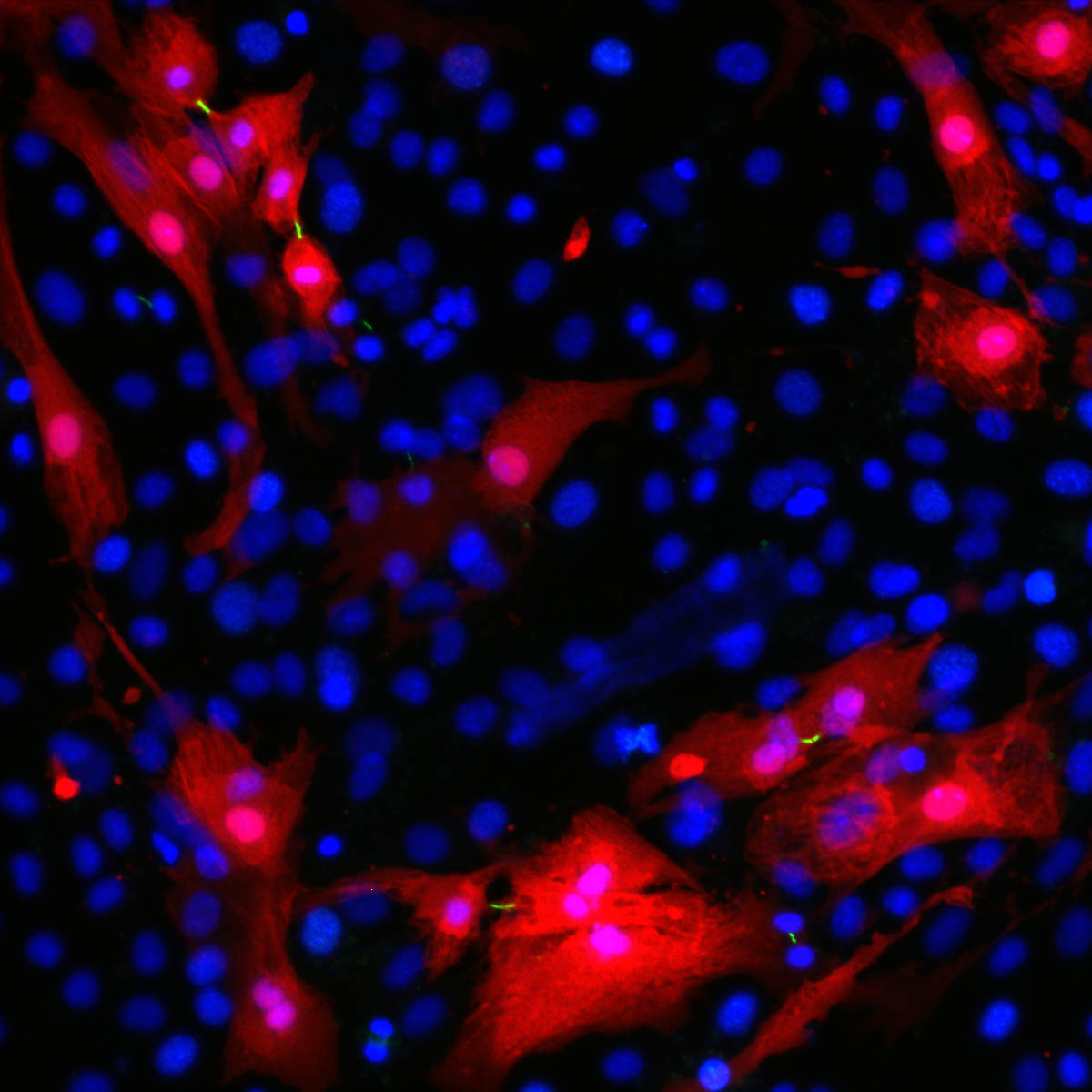
Immagine: i cardiomiociti sono contrassegnati in rosso; le linee verdi sono solchi di scissione tra le cellule in divisione. Credito:Weizmann Institute of Science.
Le malattie cardiache croniche e l’insufficienza cardiaca colpiscono fino al 10% degli adulti sopra i 65 anni. E non c’è ancora modo di rigenerare il tessuto cardiaco dopo che si è irrigidito e viene sostituito con tessuto cicatriziale in eccesso, riducendo gradualmente la sua capacità di pompare il sangue in tutto il corpo.
I ricercatori del Weizmann Institute of Science hanno ora dimostrato, nei topi, esattamente come il cuore può rigenerarsi, attivando le cellule nel tessuto cardiaco rimanente: ha solo bisogno del giusto tipo di stimolo.
Dopo la nascita, le cellule del muscolo cardiaco umano – i cardiomiociti – sono pronti per la vita. Quasi mai si dividono, rigenerano o si impegnano nella riparazione quando c’è un danno. In una ricerca precedente, gli scienziati del laboratorio del Prof. Eldad Tzahor nel Dipartimento di Biologia Cellulare Molecolare dell’Istituto avevano scoperto che i topi appena nati possono ancora rigenerare i loro cuori attivando un recettore sui cardiomiociti, chiamato ERBB2, essenziale per lo sviluppo del cuore embrionale. Quando gli scienziati hanno attivato questo recettore sulle membrane dei cardiomiociti di topi adulti subito dopo un attacco di cuore, hanno scoperto che i loro cuori potevano invertire il danno. Nel nuovo studio, Alla Aharonov, uno studente ricercatore nel laboratorio di Tzahor, si è proposto di indagare ulteriormente su questo evento apparentemente miracoloso, oltre a chiedersi se lo stesso recettore potrebbe essere attivato in una fase successiva, quando il cuore ha già subito cambiamenti nella struttura che caratterizzano l’insufficienza cardiaca.
Gli esperimenti sono stati condotti con topi transgenici progettati per produrre in eccesso ERBB2 specificamente nei cardiomiociti. L’ingegneria includeva una “chiave” per l’attivazione di questi recettori su richiesta, offrendo ai ricercatori un modo per controllare con precisione i tempi del processo di rigenerazione. I topi hanno subito attacchi di cuore e i ricercatori hanno lasciato che la situazione progredisse fino a una grave malattia cardiaca prima di utilizzare quella chiave per attivare il recettore ERBB2. La segnalazione ERBB2 in quei cardiomiociti ha fatto qualcosa di straordinario: queste cellule si sono divise e hanno formato un tessuto cardiaco nuovo di zecca.
Ulteriori ricerche hanno rivelato che dopo aver ricevuto i segnali ERBB2, i cardiomiociti adulti stavano tornando a una forma giovanile precedente. Queste cellule “ripristinate” non solo erano più inclini alla divisione, ma dopo un attento esame, gli scienziati sono stati sorpresi di notare che erano meno attaccate ai loro vicini e avevano acquisito la capacità di muoversi; avevano una forma diversa e potevano persino secernere enzimi che rompevano le cicatrici. Queste caratteristiche sono i tratti distintivi di un processo chiamato transizione epiteliale-mesenchimale (EMT) familiare dai campi dello sviluppo embrionale e delle metastasi del cancro, ma non ha precedenti nel contesto della rigenerazione del cuore.
Se i cambiamenti esterni delle cellule erano drammatici, le differenze nella loro architettura interna e molecolare non erano meno sorprendenti. Questi sono iniziati con alterazioni della “spina dorsale” strutturale delle cellule – il citoscheletro. A loro volta, i cambiamenti nel citoscheletro hanno invocato l’attivazione di una particolare via cellulare, o catena di reazioni biochimiche, che mediano gli effetti di ERBB2. Il punto centrale di questo percorso è una molecola chiamata YAP, che è un forte promotore della crescita e della divisione cellulare. Le cellule adulte, in particolare le cellule cardiache destinate a durare per tutta la vita, hanno tutti i tipi di meccanismi in atto per prevenirne l’attivazione. Nei topi ingegnerizzati, il percorso ERBB2 stava prendendo un percorso tortuoso, utilizzando il citoscheletro modificato per bypassare quegli inibitori e attivare vigorosamente YAP.
Vedi anchde:SARS-CoV-2 può influenzare il cuore
Ulteriori esperimenti con topi in cui ERBB2 era sovraespresso, ma mancava YAP, hanno confermato questa disposizione: YAP era necessario per ERBB2 per trasmettere i suoi effetti rigenerativi. Dopo alcune settimane di attivazione di ERBB2 nei topi che avevano sia ERBB2 che YAP, i cuori avevano ripristinato in larga misura la loro capacità di pompaggio.
Questo tipo di segnale, tuttavia, viene fornito con il suo avvertimento, poiché la rimozione della cicatrice utilizza lo stesso stratagemma che le cellule tumorali usano per uscire dal tessuto circostante. Tzahor afferma: “Poiché sia ERBB2 che YAP sono associati al cancro, dobbiamo essere sicuri di poter disattivare nuovamente questo percorso entro un breve periodo di tempo. In sostanza, abbiamo generato una sorta di “mini cancro” nel cuore, ed è per questo che la capacità di controllare i tempi di questi segnali era così importante. Quando abbiamo interrotto i segnali, le cellule sono maturate di nuovo in cellule adulte, non in divisione “.
“In sostanza, i meccanismi di divisione e crescita cellulare sono molto simili, indipendentemente dal fatto che il risultato finale sia lo sviluppo dell’embrione, la riparazione della ferita o il cancro”, afferma Aharonov. “Tuttavia, la connessione ERBB2-citoscheletro-YAP suggerisce che il corpo mescola un po’ le carte. Ecco perché un processo può rispecchiare il cancro, da un lato, e se applicato in modo transitorio, riparare i cuori, dall’altro. La visualizzazione della rigenerazione del cuore attraverso il prisma dell’EMT evidenzia il fatto che la rigenerazione richiede diversi eventi intrecciati se vogliamo trattare i cuori che sono sull’orlo del fallimento “.
“Questo studio dimostra qualcosa che è stato a lungo ritenuto impossibile e cioè che l’insufficienza cardiaca è reversibile e che le stesse cellule cardiache, dato il giusto stimolo, detengono la chiave “, aggiunge Tzahor.
Fonte:Wander Weizmann