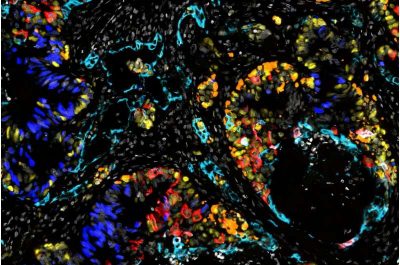
Metastasi-Immagine: immunofluorescenza multiplex di metastasi epatiche da cancro colorettale di un paziente che mostra la diversità degli stati cellulari da stati intestinali normali (blu scuro) a stati di riparazione delle lesioni altamente plastici (ciano) e simili a quelli fetali (giallo), consentendo la trasformazione (plasticità del lignaggio) in stati cellulari non intestinali: cellule simili alla pelle (rosso) e cellule neuroendocrine (arancione). Credito: Elizabeth Benite.
“Le metastasi restano la sfida principale per ridurre i decessi per cancro in tutto il mondo“, afferma Karuna Ganesh, MD, Ph.D., oncologo gastrointestinale del Memorial Sloan Kettering Cancer Center (MSK). Ciò avviene quando un tumore primario, ad esempio il cancro del colon-retto, si diffonde in una nuova parte del corpo, come il cervello, il fegato o le ossa.
Il nuovo tumore è ancora un cancro colorettale (non un cancro al cervello, al fegato o alle ossa), ma le cellule nel nuovo tumore sono anche radicalmente diverse da quelle del tumore in cui il cancro ha avuto origine. E le differenze tra i due sono critiche.
“A volte diciamo che le persone non muoiono di cancro, ma di metastasi“, afferma il Dott. Ganesh. “Sappiamo come curare i tumori primari, con la chirurgia e a volte con chemioterapia e radioterapia. Anche le malattie metastatiche rispondono spesso alla terapia di prima linea, ma non è possibile eliminare completamente tutte le cellule cancerose. Le cellule cancerose che sopravvivono al trattamento diventano sempre più aggressive e alla fine non è più possibile fermarle“.
“Per ottenere trattamenti efficaci contro le metastasi sarà necessaria una comprensione più approfondita sia dei cambiamenti che si verificano quando le cellule di un tumore primario metastatizzano, sia dei meccanismi che determinano tali cambiamenti“, aggiunge.
Ora un nuovo studio MSK, pubblicato su Nature e supervisionato dal Dott. Ganesh e dal biologo computazionale MSK Dana Pe’er, Ph.D., fornisce informazioni uniche sulle metastasi che, secondo i ricercatori, indicano nuove opportunità terapeutiche.
Uno studio evidenzia le differenze tra cancro colorettale primario e metastatico
Le scoperte degli scienziati forniscono nuovi dettagli sulla capacità delle cellule tumorali metastatiche di “viaggiare nel tempo” tornando a stati precedenti e flessibili osservati nello sviluppo embrionale, ciò che gli scienziati chiamano “plasticità cellulare”.
La plasticità si riferisce alla capacità delle cellule tumorali di perdere la propria identità (ad esempio, come cellule intestinali) e di tornare a uno stato primordiale che può dare origine a tipi di cellule completamente diversi: cellule simili a quelle della pelle (squamose), cellule simili a quelle delle ossa (osteoblasti) e cellule che rilasciano ormoni e comunicano con il sistema nervoso (neuroendocrine).
Confrontando i campioni di pazienti affetti da cancro del colon-retto in fase avanzata, il team di ricerca ha identificato chiari modelli nel modo in cui le cellule metastatiche si riprogrammano per accedere a questi stati cellulari precoci.
“Piuttosto che concentrarci sulle mutazioni genetiche che danno origine al cancro in un tumore primario, ciò su cui ci siamo concentrati qui è la capacità delle cellule tumorali di cambiare la propria identità durante la metastasi, ovvero quella di una cellula che ha iniziato come cellula intestinale per diventare un tipo di cellula completamente diverso accedendo a programmi che sono in genere disponibili solo durante le prime fasi dello sviluppo umano”, afferma il Dott. Pe’er, che è anche un ricercatore dell’Howard Hughes Medical Institute.
“Questo sforzo ha richiesto un pensiero innovativo, competenze sperimentali e computazionali sofisticate e un’ampia collaborazione tra oncologi, chirurghi e ricercatori di laboratorio con una varietà di specializzazioni, rese possibili dall’ampiezza e dalla profondità delle competenze dell’MSK, dalla cultura collaborativa e dal volume e dalla natura dei casi esaminati dai ricercatori dell’MSK”, affermano i ricercatori.
Lo studio è stato condotto dai co-primi autori Andrew Moorman, MS, biologo computazionale del Pe’er Lab, Elizabeth Benitez, studentessa di dottorato presso il Tri-Institutional e Francesco Cambuli, Ph.D., borsista post-dottorato, entrambi del Ganesh Lab.
Studio delle metastasi utilizzando tre tipi di tessuto
I ricercatori hanno raccolto tre campioni da ciascuno dei 31 pazienti: dal tumore primario, dal tessuto sano circostante e dal tessuto metastatico (solitamente dal fegato).
I ricercatori hanno poi utilizzato il sequenziamento dell’RNA a singola cellula, la microscopia avanzata a immunofluorescenza e gli organoidi (organi modello in miniatura coltivati in laboratorio) generati dai campioni per studiare l’evoluzione delle cellule tumorali durante la metastasi.
Lo studio ha incluso pazienti che non avevano ancora ricevuto alcun trattamento oncologico, così come coloro che avevano ricevuto chemioterapia prima dell’intervento chirurgico. Ad alcuni pazienti sono stati raccolti campioni aggiuntivi in un secondo momento.
Analizzare trii di tessuti abbinati da un gruppo di pazienti è un modo innovativo per ottenere informazioni su una delle sfide più grandi del cancro. “I modelli di laboratorio standard, come le linee cellulari o i topi, non possono rispondere prontamente a domande chiave sul perché le metastasi acquisiscano capacità così aggressive che alla fine uccidono, cosa che i tumori primari da soli di solito non fanno“, affermano i ricercatori.
“I modelli murini di cancro spesso non metastatizzano e, quando ciò avviene, il processo è notevolmente accelerato rispetto al modo in cui il cancro si evolve negli esseri umani, il che significa che non sono particolarmente accurati per comprendere lo sviluppo della plasticità nei tumori umani su scale temporali umane“, afferma il Dott. Pe’er.
“Abbiamo pensato che fosse davvero importante guardare alla malattia per la quale abbiamo bisogno di trattamenti migliori, che è il cancro avanzato negli esseri umani“, dice il Dott. Ganesh. “Quindi abbiamo dovuto essere un po’ creativi, perché quando i pazienti hanno una malattia metastatica, non eseguiamo spesso interventi chirurgici per eliminarla“.
Inoltre, la chirurgia è un campo molto specializzato. A volte i chirurghi asportano una parte del fegato per rimuovere una metastasi, ma in genere un chirurgo diverso opererebbe sul colon per rimuovere un tumore primario.
“Quindi abbiamo dovuto davvero riunire un gruppo ampio e collaborativo per raccogliere e studiare questi diversi campioni durante un intervento chirurgico“, aggiunge il Dott. Ganesh. “Quello che siamo stati in grado di realizzare, ovvero riuscire a esaminare il tessuto normale, il tumore primario e le metastasi degli stessi pazienti nello stesso momento, non era mai stato fatto prima su questa scala“.
Verso una comprensione più profonda delle metastasi
La transizione delle cellule sane ai tumori primari nel cancro colorettale è stata ampiamente studiata. Durante questa trasformazione, le cellule tumorali adottano le proprietà delle cellule staminali intestinali, che rinnovano e riparano il tessuto intestinale. Questo è il loro primo viaggio indietro nel tempo verso uno stato più primitivo.
Il nuovo studio dimostra per la prima volta, e contrariamente alla saggezza comune, che le cellule del cancro colorettale metastatico non assomigliano alle cellule staminali intestinali presenti nel tumore primario. Invece, più le cellule metastatiche si dividono ed evolvono nel tempo, più perdono la loro identità originale di cellule intestinali.
Leggi anche:Metastasi: come gestire la malattia metastatica?
Un’analisi computazionale sofisticata ha rivelato uno schema chiaro:
“Nonostante tutte le normali variazioni che osserviamo da un tumore all’altro, le cellule nei tumori di ogni paziente convergono in uno stato simile a quello fetale”, afferma il Dott. Pe’er.
Questo stato assomiglia molto all’endoderma primordiale, ovvero le cellule che alla fine daranno origine all’intestino nel primo trimestre dello sviluppo embrionale.
Da lì, le cellule metastatiche viaggiano ancora più indietro nel tempo, fino a un punto in cui non sono più destinate a diventare cellule intestinali e possono invece trasformarsi in cellule della pelle, delle ossa o dei nervi.
“La firma che abbiamo trovato assomiglia molto a ciò che accade nella settimana 6 durante lo sviluppo“, afferma il Dott. Pe’er. “Settimana 6, giorno 6.6, per essere precisi“.
Implicazioni per il trattamento del cancro metastatico
“Tutto questo viaggio nel tempo compiuto dalle cellule tumorali è un meccanismo di sopravvivenza, un adattamento che le aiuta a sopravvivere allo stress, in particolare agli attacchi dei trattamenti contro il cancro”, afferma il Dott. Ganesh.
Nei pazienti, le cellule metastatiche tornano tutte indietro nello stesso punto nel tempo, dove possono attivare programmi genetici associati a diversi tipi di cellule, il che consente loro di acquisire la capacità di metastatizzare in diversi tessuti e le rende più resistenti ai farmaci antitumorali.
“Da un punto di vista clinico, pensiamo che questo sia profondamente importante”, afferma il Dott. Ganesh. “Se c’è uno stato specifico in cui queste cellule devono entrare, per rigenerare un tumore dopo la terapia, questo è un collo di bottiglia, una vulnerabilità“.
“Questa scoperta offre opportunità per colpire la capacità delle cellule tumorali di entrare in questo stato primordiale, così come per colpire lo stato stesso”, afferma il Dott. Ganesh. La ricerca su entrambi gli approcci è in corso presso l’MSK.
Cosa insegnano gli organoidi ai ricercatori
È anche qui che gli organoidi creati dai campioni dei pazienti abbinati forniscono informazioni che non sarebbero possibili utilizzando altri metodi.
“Sappiamo ora che le cellule tumorali metastatiche e primarie sono diverse, ma gli organoidi ci permettono davvero di chiederci: ‘Perché sono diverse?‘”, afferma il Dott. Ganesh. “Rispondono a segnali diversi nel fegato rispetto al colon?”.
Si scopre che le cellule tumorali primarie che hanno origine nel colon possono vivere solo nel colon; non possono adattarsi all’ambiente nel fegato. Le cellule metastatiche, d’altro canto, possono sopravvivere sia nel colon che nel fegato.
“Quindi questo ci dice che hanno una maggiore plasticità”, aggiunge il Dott. Ganesh. “Questa ricerca è davvero la prima dimostrazione che c’è un tipo di plasticità all’opera nelle cellule metastatiche che consente questo adattamento a diversi segnali microambientali“.
In definitiva, il team è ottimista sul fatto che le sue scoperte possano tracciare una strada per comprendere meglio le metastasi e, in futuro, per intervenire sulla plasticità cellulare nei tumori avanzati.
Fonte:Nature