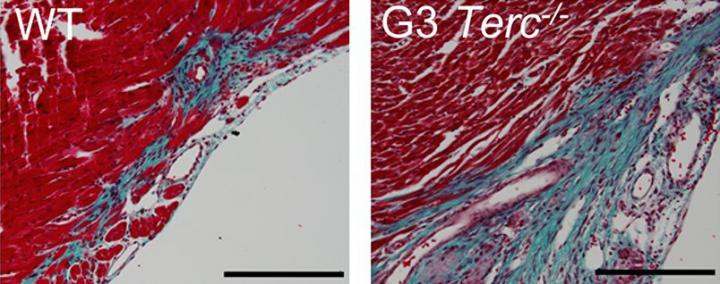
Immagine: topi telomerasi/deficienti subiscono un accorciamento dei telomeri e quindi non sono in grado di rigenerare il tessuto cardiaco danneggiato, anche solo dopo un giorno di vita. Il tessuto cardiaco telomerasi-deficienei (a destra) ha grandi regioni fibrotiche (blu) rispetto al wild-type del miocardio (a sinistra). Credit: Aix et al ., 2016
Uno studio sui topi collega la riparazione del cuore alla lunghezza dei telomeri.
I ricercatori del Centro Nazionale Spagnolo per la ricerca cardiovascolare hanno scoperto che le estremità dei cromosomi delle cellule del muscolo cardiaco, i telomeri, si erodono rapidamente subito dopo la nascita, limitando la capacità delle cellule di proliferare e sostituire il tessuto cardiaco danneggiato.
Lo studio, “Postnatal telomere dysfunction induces cardiomyocyte cell-cycle arrest through p21 activation“, è stato pubblicato il 30 maggio 2016 dal The Journal of Cell Biology e suggerisce possibili nuovi interventi per aumentare la capacità del cuore di riparare se stesso dopo un attacco di cuore.
I neonati possono riparare il miocardio danneggiato, ma negli adulti, gli attacchi di cuore causano danni permanenti che spesso conducono ad insufficienza cardiaca. Anche i topi neonati possono riparare il loro tessuto cardiaco danneggiato. Le cellule del loro muscolo cardiaco o cardiomiociti possono proliferare e riparare il cuore danneggiato nella prima settimana di vita, ma questa capacità svanisce quando i topi invecchiano e la maggior parte dei loro cardiomiociti si ritirano dal ciclo cellulare.
Ignacio Flores e colleghi del Centro Nazionale Spagnolo per la ricerca cardiovascolare di Madrid, si sono interrogati sulle cause di questo arresto del ciclo cellulare e se esso avrebbe potuto coinvolgere i telomeri, sequenze di DNA ripetitivo che proteggono le estremità dei cromosomi. Se i telomeri diventano troppo corti, a causa ad esempio di una perdita di telomerasi, le cellule possono confondere il cromosoma con arresto di crescita, con i segmenti di DNA danneggiato e portare all’attivazione dell’arresto del ciclo cellulare.
Flores e colleghi hanno esaminato la lunghezza dei telomeri nei cardiomiociti di topi neonati ed hanno scoperto che i telomeri si erano rapidamente erosi dopo la prima settimana dalla nascita. Questa erosione è coincisa con una diminuzione della telomerasi ed era accompagnata dall’attivazione della risposta al danno al DNA e dall’attivazione di un inibitore del ciclo cellulare chiamato p21.
Topi telomerasi/deficienti hanno telomeri più corti rispetto a topi normali ed i ricercatori hanno anche scoperto che i cardiomiociti smettono di proliferare il giorno dopo la nascita. Quando Flores e colleghi hanno causato danni al cuore di vecchi topi, i cardiomiociti telomerasi-deficienti, non sono riusciti a proliferare o rigenerare il miocardio danneggiato.
I ricercatori hanno anche scoperto che l’inibizione di p21 ha esteso la capacità di rigenerazione dei cardiomiociti e permesso ai vecchi topi di riparare il tessuto cardiaco danneggiato in modo più efficiente rispetto ai vecchi topi normali.
Mantenere la lunghezza dei telomeri nei cardiomiociti potrebbe quindi migliorare la capacità di rigenerazione delle cellule cardiache adulte e migliorare la capacità il recupero del tessuto cardiaco danneggiato a seguito di infarto.
” Ora stiamo sviluppando modelli di topo di sovraespressione della telomerasi per vedere se riusciamo ad estendere la finestra rigenerativa”, ha concluso Flores.
Fonte: The Journal of Cell Biology