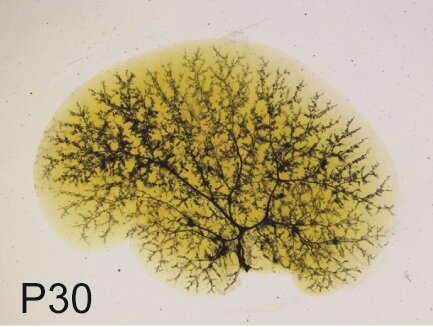
Immagine, albero biliare nella sindrome di Alagille. Credito: Kari Huppert / Epatologia, 2019.
La sindrome di Alagille è una rara malattia genetica pediatrica che può colpire fegato, cuore, reni, vasi sanguigni, scheletro e altri tessuti. Una delle principali caratteristiche di questa condizione sono le anomalie nei dotti che trasportano la bile dal fegato alla cistifellea e all’intestino tenue. Il numero di dotti biliari è gravemente ridotto nei pazienti con sindrome di Alagille, il che riduce il normale flusso di bile, una condizione chiamata colestasi. Di conseguenza, la bile si accumula nel fegato, causando cicatrici che impediscono al fegato di funzionare correttamente per svolgere le sue funzioni metaboliche ed eliminare i rifiuti dal flusso sanguigno.
“La gravità del disturbo varia tra le persone colpite, anche all’interno della stessa famiglia”, spiega Jafar-Nejad. “Ad esempio, alcuni pazienti con colestasi infantile richiederanno un trapianto di fegato, mentre altre mostreranno un miglioramento significativo in età scolare elementare, eliminando la necessità di un trapianto”. Ciò che media questa variabilità non è noto.
In questo studio, Jafar-Nejad e i suoi colleghi hanno scoperto nuovi indizi genetici che contribuiscono alla nostra comprensione dell’estrema variabilità nell’ espressione di questa malattia epatica infantile e offrono anche una potenziale via terapeutica per questa condizione.
La strada per la scoperta
La maggior parte dei casi di sindrome di Alagille deriva dalla perdita di una copia del gene JAG1, che produce la proteina JAG1, un componente importante della via di segnalazione di Notch.
Il percorso di Notch è coinvolto nella comunicazione tra cellule vicine durante lo sviluppo embrionale e il mantenimento del tessuto adulto. I segnali del percorso Notch influenzano il modo in cui le cellule costruiscono le strutture corporee nell’embrione in via di sviluppo. Pertanto, le mutazioni in JAG1 o altri componenti della via di Notch portano ad errori durante lo sviluppo che colpiscono i dotti biliari e altri organi.
Diversi anni fa, il laboratorio Jafar-Nejad ha istituito un modello murino geneticamente rappresentativo per la malattia del fegato con sindrome di Alagille. In questo modello, la perdita di una copia di Jag1 (Jag1 +/-) comporta uno sviluppo alterato del dotto biliare e la successiva colestasi nei topi.
Nel presente studio, il gruppo ha utilizzato questo modello per identificare modificatori genetici della malattia epatica al fine di spiegare la sua variabilità e identificare un potenziale bersaglio terapeutico. I ricercatori hanno scoperto che il livello di espressione del fattore di trascrizione SOX9 ha ampiamente modificato la gravità della malattia epatica della sindrome di Alagille nei topi.
Secondo precedenti lavori di altri ricercatori, la completa perdita del gene Sox9 nel normale fegato di topo ha avuto solo effetti transitori sullo sviluppo del dotto biliare, senza conseguenze a lungo termine. In questo studio, i ricercatori hanno scoperto che il cambiamento dell’espressione genica di Sox9 nei fegati di topi con sindrome di Alagille (Jag1 +/-) ha influenzato profondamente la patologia epatica.
“È stato incredibile vedere quanto fossero sensibili i topi Jag1 +/- ai livelli di Sox9”, ha dichiarato il primo autore dello studio Joshua Adams, studente nel programma in biologia dello sviluppo al Baylor. “Anche la perdita di una sola copia del gene Sox9 nel nostro modello murino di sindrome di Alagille ha peggiorato significativamente la malattia epatica, mostrando evidenze di infiammazione e fibrosi epatica potenziate“.
Inoltre, i ricercatori hanno esaminato la struttura dei dotti biliari in collaborazione con il gruppo del Dr. Stacey Huppert presso il Cincinnati Children’s Hospital Medical Center. L’iniezione di inchiostro nel dotto biliare comune ha mostrato difetti nella struttura tridimensionale dell’albero biliare negli animali Jag1 +/- di un mese, ma questa e altre caratteristiche del fegato Jag1 +/- sono migliorate con l’età. D’altra parte, gli animali ai quali mancava simultaneamente una copia del gene Jag1 (Jag +/-) e una copia del gene Sox9, presentavano una condizione più grave a un mese di età e non mostravano miglioramenti delle loro condizioni epatiche con l’età. La rimozione di entrambe le copie del gene Sox9 nei fegati di animali Jag1 +/- ha comportato una mortalità del 50% entro tre settimane di età, evidenziando ulteriormente il ruolo critico di SOX9 nella gravità della malattia epatica di Jag1 +/-.
“I nostri dati suggeriscono che le alterazioni del livello di espressione di un gene (Sox9) negli animali Jag1 +/- possono generare l’intera gamma di variazioni nelle malattie del fegato osservate nei pazienti umani”, ha detto Jafar-Nejad.
Quando Jafar-Nejad, Adams e i loro colleghi hanno studiato campioni di fegato di pazienti affetti dalla sindrome di Alagille, hanno scoperto che SOX9 può anche essere associato alla variabilità osservata nella condizione umana. Hanno scoperto che il livello di espressione e il pattern di SOX9 nel fegato sono abbastanza diversi nei pazienti con sindrome del fegato di Alagille con malattia epatica lieve rispetto ai pazienti con sindrome del fegato di Alagille con malattia epatica grave.
Sox9 può essere un bersaglio terapeutico nella sindrome di Alagille
La scoperta che la riduzione dei livelli di Sox9 ha aumentato la gravità delle condizioni epatiche nel modello murino della sindrome di Alagille ha portato i ricercatori a testare la possibilità che l’aumento dei livelli di Sox9 possa migliorare le condizioni epatiche in questo modello.
“È stato emozionante scoprire che l’aumento dei livelli di Sox9 nei fegati dei topi con sindrome di Alagille ha notevolmente migliorato lo sviluppo del dotto biliare senza provocare la formazione di tumori, anche dopo un anno“, ha detto Adams. “Comprendendo ulteriormente perché i fegati carenti di Jag1 sono così sensibili a Sox9 e in che modo l’aumento dell’espressione genica di Sox9 migliora lo sviluppo biliare senza effetti negativi sul fegato, possiamo avvicinarci allo sviluppo di una strategia terapeutica per la malattia del fegato con sindrome di Alagille”.
Fonte, Hepatology