Una nuova ricerca fornisce una migliore comprensione dei meccanismi alla base dello sviluppo della sclerosi laterale amiotrofica (SLA) e indica una potenziale strategia di trattamento. Il lavoro è stato condotto da ricercatori dell’Healey Center for ALS del Massachusetts General Hospital (MGH) ed è stato pubblicato su Molecular Neurobiology.
La SLA, una condizione degenerativa senza cura, attacca le cellule nervose del cervello e del midollo spinale per influenzare progressivamente la capacità degli individui di muoversi, parlare, mangiare e persino respirare. Precedenti studi hanno indicato che la disfunzione all’interno dei mitocondri, che generano energia all’interno delle cellule, svolge un ruolo importante nello sviluppo della SLA. Inoltre, gli studi sulla malattia di Alzheimer hanno collegato i cambiamenti nella funzione mitocondriale alle interazioni tra una forma anormale di tau, che si accumula nel cervello dei pazienti con malattia di Alzheimer e una proteina mitocondriale chiamata proteina 1 correlata alla dinamina (DRP1). Mettendo insieme queste informazioni, Ghazaleh Sadri-Vakili, Ph.D., Direttore del Laboratorio di NeuroEpigenetica presso il MassGeneral Institute for Neurodegenerative Disease e l’Healey Center for ALS presso MGH, hanno elaborato nuove intuizioni e nuove strategie per la SLA.
Vedi anche:SLA e demenza attaccate da un composto cacciatore di RNA
Il team ha scoperto che nel tessuto cerebrale di pazienti deceduti affetti da SLA è presente la forma anormale di tau, che si trova dove normalmente la tau non si trova e interagisce con la DRP1. Quando le cellule sono state coltivate a contatto con il tessuto cerebrale di pazienti deceduti con SLA che conteneva tau anormale, i mitocondri delle cellule si sono frammentati e lo stress ossidativo è aumentato. È importante sottolineare che la riduzione della tau con un degradatore specifico ha invertito questi effetti, riducendo la frammentazione mitocondriale e abbassando lo stress ossidativo.
Spiegano gli autori:
“Comprendere i meccanismi alla base della sclerosi laterale amiotrofica (SLA) è fondamentale per lo sviluppo di nuove terapie. Precedenti studi hanno dimostrato che la disfunzione mitocondriale è un evento patogenetico chiave nella SLA. È interessante notare che gli studi sul cervello post-mortem della malattia di Alzheimer (AD) e nei modelli animali, collegano le alterazioni nella funzione mitocondriale alle interazioni tra la tau iperfosforilata e la proteina 1 correlata alla dinamina (DRP1), la GTPasi coinvolta nella fissione mitocondriale. Prove recenti suggeriscono che la tau può essere coinvolta nella patogenesi della SLA, pertanto, abbiamo cercato di determinare come la tau iperfosforilata può portare alla frammentazione e disfunzione mitocondriale nella SLA e se la riduzione della tau può fornire un nuovo approccio terapeutico. I nostri risultati hanno dimostrato che pTau-S396 è mal localizzata nelle sinapsi nella corteccia motoria post-mortem (mCTX) attraverso i sottotipi di SLA. Inoltre, il trattamento con i sinaptoneurosomi (SN) della SLA, arricchiti in pTau-S396, ha aumentato lo stress ossidativo, ha indotto la frammentazione mitocondriale e ha alterato la connettività mitocondriale senza influire sulla sopravvivenza cellulare in vitro. Inoltre, pTau-S396 ha interagito con DRP1 e, simile a pTau-S396, DRP1 si è accumulato negli SN attraverso i sottotipi di SLA, suggerendo aumenti nella frammentazione mitocondriale nella SLA. Come riportato in precedenza, la microscopia elettronica ha rivelato una significativa diminuzione della densità e della lunghezza dei mitocondri nella SLA mCTX. Infine, la riduzione dei livelli di tau con QC-01-175, un degradatore selettivo della tau, ha prevenuto la frammentazione mitocondriale e lo stress ossidativo indotti dalla condizione in vitro“.
astratto grafico
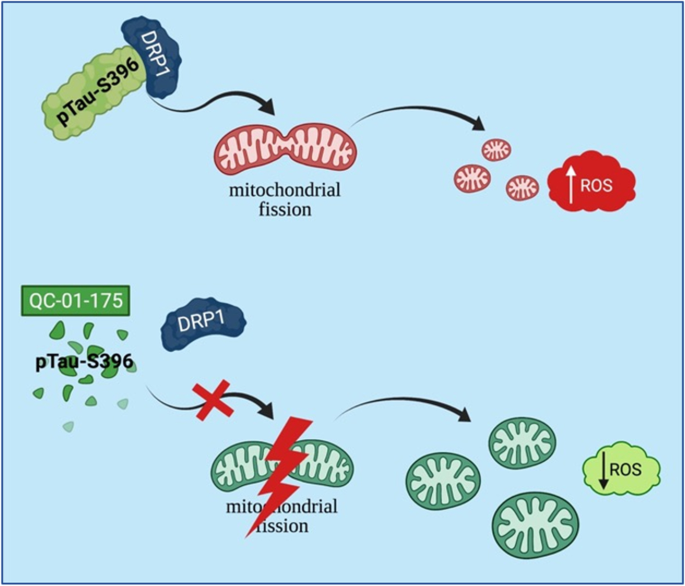
Immagine Credito ‘Healey Center for ALS del Massachusetts General Hospital (MGH)
“Abbiamo dimostrato per la prima volta che prendere di mira la tau con una nuova classe di piccole molecole che la degradano selettivamente può invertire i cambiamenti indotti dalla SLA nella forma e nella funzione dei mitocondri, evidenziando la tau come potenziale bersaglio terapeutico“, afferma Sadri-Vakili.
Fonte:Molecular Neurobiology