Circa 5.000 persone negli Stati Uniti sviluppano la sclerosi laterale amiotrofica (SLA) ogni anno. In media, sopravvivono solo per due o cinque anni dopo la diagnosi, secondo i Centers for Disease Control and Prevention.
La malattia neurodegenerativa in rapida progressione causa la morte dei neuroni nel cervello e nel midollo spinale, con conseguente debolezza muscolare, insufficienza respiratoria e demenza. Nonostante la natura devastante della malattia, si sa poco su cosa innesca per primo il deterioramento dei motoneuroni all’insorgenza della SLA.
Ora, i ricercatori dell’Università della California di San Diego e i loro colleghi riferiscono di aver identificato un percorso chiave che innesca la neurodegenerazione nelle fasi iniziali della malattia. I risultati potrebbero portare allo sviluppo di terapie per prevenire o rallentare la progressione della SLA in una fase iniziale, prima che si siano verificati danni gravi.
Lo studio è stato pubblicato il 31 ottobre 2024 su Neuron.
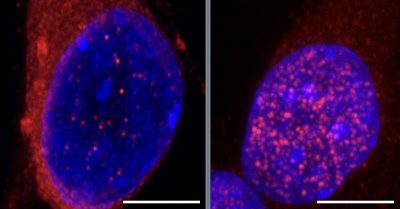
Una proteina chiamata TDP-43 si trova solitamente nel nucleo dei motoneuroni, dove regola l’espressione genica necessaria al funzionamento delle cellule. Gli studi hanno dimostrato che quando la TDP-43 si accumula invece nel citoplasma, al di fuori del nucleo, è un segno rivelatore di SLA. Il modo in cui la proteina finisce nel posto sbagliato, portando alla degenerazione neuronale, ha lasciato perplessi i ricercatori fino ad ora.
“Quando vedi un paziente affetto da SLA e vedi la proteina TDP-43 aggregata nel citoplasma, è come se si trovasse sul luogo dell’incidente, con tutte le auto già distrutte, ma non è quello l’evento scatenante”, ha affermato l’autore corrispondente Gene Yeo, Ph.D., Professore presso il Dipartimento di Medicina Cellulare e Molecolare della Facoltà di Medicina dell’UC San Diego e Direttore del Center for RNA Technologies and Therapeutics e del Sanford Stem Cell Institute Innovation Center.
Tracciando gli eventi che hanno portato all'”incidente”, Yeo spiega che un’altra proteina, chiamata CHMP7, normalmente presente nel citoplasma, si accumula invece nel nucleo, innescando una cascata di eventi che alla fine portano alla degenerazione dei motoneuroni.
Ma cosa causa l’accumulo di CHMP7 nel nucleo per cominciare?
Yeo e il suo team hanno esaminato le proteine leganti l’RNA che potrebbero influenzare l’accumulo di CHMP7 nel nucleo. Ciò ha prodotto 55 proteine, 23 delle quali avevano una potenziale connessione con la patogenesi della SLA. L’inibizione della produzione di diverse di queste proteine ha portato a un aumento di CHMP7 nel nucleo.
Ulteriori esperimenti con motoneuroni creati da cellule staminali pluripotenti indotte derivate da pazienti affetti da SLA hanno portato alla sorprendente scoperta che l’esaurimento di una di queste, una proteina associata allo splicing dell’RNA chiamata SmD1, di cui non si sapeva in precedenza che influenzasse i livelli di CHMP7, ha portato al maggiore aumento del suo accumulo nucleare.

Immagine Credito Neuron (2024).
Un accumulo di CHMP7 nel nucleo danneggia le nucleoporine, che Yeo paragona a minuscoli portali nella membrana che separa il nucleo dal citoplasma che orchestrano il movimento di proteine e RNA tra i due spazi cellulari. Le nucleoporine disfunzionali consentono a TDP-43 di uscire dal nucleo e accumularsi nel citoplasma. Una volta lì, la proteina non può più supervisionare i programmi di espressione genica necessari al funzionamento dei neuroni.
Tuttavia, quando i ricercatori hanno aumentato l’espressione di SmD1 nelle cellule, CHMP7 è stato riportato nella sua posizione abituale nel citoplasma, lasciando intatti i nucleopori, consentendo a TDP-43 di rimanere nel nucleo, risparmiando così i motoneuroni dalla degenerazione.
“È possibile effettivamente correggere la localizzazione di questa proteina CHMP7 e quindi tutti gli effetti a valle“, ha affermato Norah Al-Azzam, prima autrice dello studio, allora studentessa di neuroscienze nel laboratorio di Yeo che ha conseguito il dottorato di ricerca nella primavera del 2024.
Inoltre, la proteina SmD1 fa parte di SMN, un complesso multiproteico. La disfunzione di SMN è implicata in un altro disturbo neurodegenerativo, l’atrofia muscolare spinale.
“Siamo incuriositi perché in realtà esistono delle terapie per l’atrofia muscolare spinale“, ha detto Yeo. “Una di queste, il Risdiplam, è un composto di piccole molecole che potenzia lo splicing e l’espressione di SMN2, un gene strettamente correlato al gene SMN1 che diventa disfunzionale nella SLA“.
Ciò suggerisce la possibilità che l’uso di Risdiplam per aumentare i livelli di SMN potrebbe impedire che la SLA si sviluppi oltre la fase iniziale della malattia.
“Non è che tutti i neuroni muoiano contemporaneamente”, ha detto Yeo. “Alcuni neuroni muoiono prima e poi si diffondono in altri neuroni. Forse non appena si manifestano i sintomi, potremmo curare il paziente in modo che il resto dei neuroni non crolli e sperare di fermare la progressione della SLA“.
Leggi anche La genetica mitocondriale fa luce sul rischio e sulla protezione della SLA
I ricercatori pensano che il complesso SMN potrebbe svolgere un ruolo cruciale nell’insorgenza della SLA, ma sono necessarie ulteriori ricerche. I prossimi passi saranno raccogliere fondi per continuare la ricerca su modelli animali e su altri modelli genetici di SLA, e infine testare l’efficacia del Risdiplam o di altri composti per il cortocircuito della SLA.