(SLA: Immagine Credit Public Domain).
Il ricercatore P. Hand Ozdinler e colleghi della Feinberg School of Medicine presso la Northwestern University, hanno indagato se i macrofagi periferici svolgono un ruolo nella patologia della sclerosi laterale amiotrofica (SLA), scoprendo che i macrofagi lungo gli assoni dei motoneuroni periferici reagiscono alla neurodegenerazione. La modifica della segnalazione delle specie reattive dell’ossigeno (ROS) nei macrofagi periferici, utilizzando la sostituzione delle cellule del midollo osseo, riduce la risposta infiammatoria sia dei macrofagi che della microglia, ritarda la patologia e aumenta la sopravvivenza nei modelli murini di SLA.
La SLA (sclerosi laterale amiotrofica) è una delle malattie neurodegenerative più complesse, non solo perché colpisce sia il cervello che il midollo spinale, ma anche perché un ampio spettro di neuroni e cellule non neuronali contribuisce alla patologia della malattia. Comprendere le cause alla base della malattia e costruire strategie di trattamento efficaci è quindi impegnativo. I motoneuroni superiori e inferiori sono uno dei principali tipi di cellule colpiti dalla SLA, mostrando una precoce vulnerabilità e una progressiva degenerazione. La patologia dei motoneuroni potrebbe derivare da fattori sia intrinseci che estrinseci. I fattori estrinseci sono sfaccettati e dinamici, tanto che la SLA è considerata una malattia “non autonoma delle cellule”, con cellule gliali, in particolare la microglia, che si ritiene contribuiscano alla velocità e all’entità della progressione della malattia.
Le cellule mieloidi si presentano in molte forme diverse, con il lignaggio mieloide che dà origine a monociti, macrofagi e microglia, ciascuno con ruoli e funzioni differenti. Poiché i loro corpi cellulari si trovano nel midollo spinale e gli assoni si proiettano al muscolo, i motoneuroni spinali sono esposti sia alle microglia del SNC attorno al loro soma che ai macrofagi del sistema nervoso periferico lungo i loro assoni. Tuttavia, ad oggi la maggior parte della ricerca si è concentrata sul ruolo della microglia del SNC nella degenerazione dei motoneuroni, con poca enfasi sul potenziale contributo dei macrofagi periferici.
In questo numero di Nature Neuroscience, i ricercatori indagano il ruolo specifico dei macrofagi periferici situati lungo gli assoni dei motoneuroni spinali nella patologia SLA, distinti dalla microglia nel corno ventrale del midollo spinale. I ricercatori hanno usato l’agente chemioterapico Busulfan per indurre la mieloablazione e quindi hanno eseguito il trapianto di cellule del midollo osseo che esprimono GFP nel midollo osseo di modelli murini di SLA mutanti SOD1 a progressione lenta e rapida, in un’età presintomatica. I trapianti di midollo osseo che esprimono GFP (Green Fluorescent Protein-base) sono stati usati per primi per studiare il tasso delle cellule derivate dal midollo osseo nel sistema nervoso centrale. In esperimenti successivi, i trapianti sono stati utilizzati per sostituire i macrofagi periferici con versioni geneticamente modificate, in modo tale che la via di segnale delle specie reattive dell’ossigeno (ROS) fosse modulata, per studiare l’impatto di questa modulazione sui macrofagi sia periferici che centrali e, in definitiva, sulla degenerazione del motore spinale e comportamento della funzione motoria.
La misura in cui monociti e macrofagi derivati dal midollo osseo si infiltrano nel sistema nervoso centrale durante la SLA e contribuiscono alla patologia è stato argomento di dibattito per molti anni. Precedenti studi sull’irradiazione sono stati messi in dubbio perché porta anche alla rottura della barriera ematoencefalica (BBB) indotta dall’irradiazione. Come approccio alternativo, p rocercatori hanno usato Busulfan, che non ha avuto un impatto sulla barriera emato-encefalica, per ablare cellule endogene derivate dal midollo osseo e le ha sostituite con cellule innestate con marcate GFP. È interessante notare che i livelli di infiltrazione di monociti e macrofagi al midollo spinale erano quasi trascurabili, raggiungendo circa l’8% durante le fasi sintomatiche tardive, mentre raggiungono il 75% in periferia, specialmente nel modello a progressione rapida.
Vedi anche:SLA:farmaco riduce l’eccitabilità dei motoneuroni
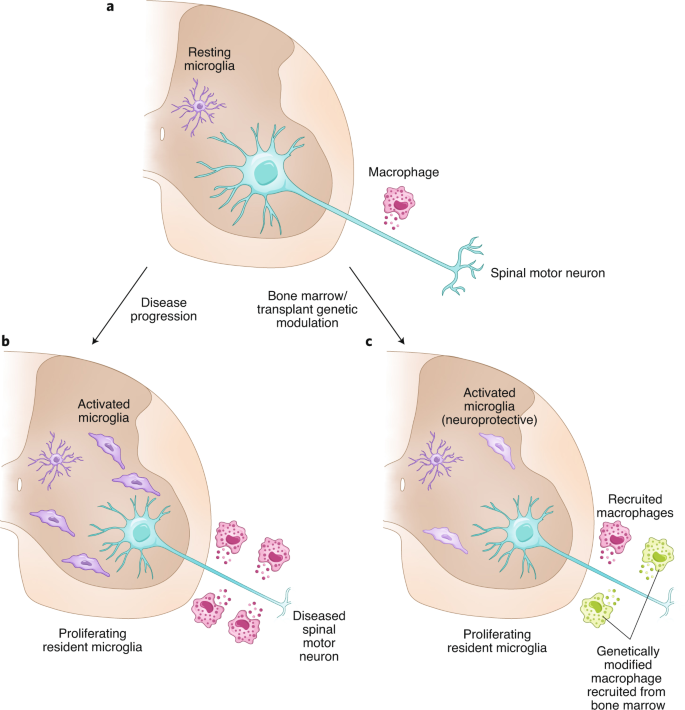
I risultati più interessanti sono emersi quando una serie di esperimenti di modulazione genica sono stati eseguiti con cellule GFP + del midollo osseo trapiantate nel midollo osseo in una fase precoce della malattia. In primo luogo, i ricercatori hanno sostituito i macrofagi periferici che esprimono SOD1 mutanti con altri sani, ma ciò non sembrava promuovere una significativa neuroprotezione. Quindi, hanno sottoregolato i livelli di Nox2, un contributore chiave alla segnalazione ROS che, una volta ablato, ha mostrato uno dei miglioramenti più robusti nei topi mutanti SOD1. Questa modulazione ha provocato notevoli cambiamenti nella periferia, ma soprattutto nel SNC. L’attivazione dei macrofagi periferici è stata ridotta lungo l’assone, così come l’attivazione della microglia nel sistema nervoso centrale in prossimità dei corpi cellulari dei motoneuroni spinali. L’attivazione della microglia del SNC è una delle caratteristiche chiave che contribuiscono alla degenerazione dei motoneuroni nel modello SOD1. Dimostrare che la modulazione genetica della periferia può modulare l’attivazione della microglia nel SNC è quindi intrigante (Fig.1).
a , b , I macrofagi periferici lungo gli assoni dei motoneuroni spinali e la microglia nel midollo spinale vengono attivati durante la progressione della malattia nei topi hSOD1 G93A e negli esseri umani con SLA. c , La mieloablazione con Busulfan seguita da trapianto di midollo osseo di cellule eGFP +porta a una limitata infiltrazione di cellule mieloidi nel SNC, ma a una sostituzione efficiente dei macrofagi nervosi periferici. La modulazione genetica della via dei ROS, ablando Nox2 e aumentando la SOD1 all’interno delle cellule del midollo osseo che danno origine ai macrofagi periferici, si traduce anche in cambiamenti nel profilo di espressione genica dei macrofagi centrali, trasformandoli in uno stato più neuroprotettivo, che alla fine influisce sul comportamento motorio e sopravvivenza. (Immagine a grandezza naturale).
Poiché la patologia SLA progredisce nel tempo, trovare il momento più efficace per la modulazione è una sfida importante. Esperimenti condotti in molti stadi diversi della malattia suggeriscono i benefici dell’intervento precoce e che la modifica dei macrofagi alla periferia rallenta la progressione della malattia e aumenta la sopravvivenza.
Vedi anche:SLA: individuato nuovo candidato biomarker
Ma questo come avviene?
Come passaggio finale, i ricercatori hanno eseguito analisi di sequenziamento dell’RNA per studiare i cambiamenti nei profili di espressione genica dei macrofagi sia periferici che centrali, scoprendo che queste due cellule reagiscono in modo molto diverso alla patologia della malattia. A causa di meccanismi sconosciuti, la modulazione nella periferia ha provocato cambiamenti nell’espressione genica dei macrofagi centrali, trasformandoli in una modalità meno attiva e più “neuroprotettiva”.
Come spesso accade con studi entusiasmanti, emergono più domande di quante i risultati possano soddisfare.
Ad esempio, come possono i macrofagi periferici avere un impatto così profondo sulla microglia del SNC, soprattutto data la loro infiltrazione limitata nel SNC? Quale sarebbe la modalità di comunicazione tra di loro? Se la comunicazione è mediata tramite esosomi, ciò influenzerebbe anche la corteccia? Possono verificarsi cambiamenti simili anche nei macrofagi della corteccia motoria, che sono noti per svolgere un ruolo significativo nella degenerazione dei motoneuroni superiori? È anche inaspettato che, sebbene sia la sopravvivenza che il comportamento dei topi migliorino, il numero dei motoneuroni spinali continui a diminuire con la progressione della malattia. È possibile che l’integrità delle giunzioni neuromuscolari sia protetta meglio?
Questi sono tempi entusiasmanti per la costruzione di terapie efficaci per la SLA, ed è interessante scoprire che l’aiuto può davvero venire dalla periferia. C’è stato un dibattito attivo sul ruolo dell’infiltrazione dei monociti nel SNC e dei macrofagi derivati dai monociti e questo studio può offrirci una nuova prospettiva. I risultati suggeriscono che i macrofagi periferici, se modulati correttamente e al momento giusto, possono avere un impatto sulla microglia del SNC, trasformandoli in uno stato più “neuroprotettivo” e offrendo un beneficio terapeutico globale per migliorare la funzione motoria nella SLA
Fonte:Nature Neuroscience