Un nuovo studio del Salk Institute collega il deterioramento del DNA cellulare all’invecchiamento precoce nella sindrome di Werner. I risultati di questo studio sull’invecchiamento precoce potrebbero portare a rallentare o invertire il processo di invecchiamento e a nuove cure per le malattie collegate all’età come il morbo di alzheimer, il cancro e il diabete.
Lo studio è stato pubblicato sulla rivista Science.
Gli scienziati del Salk Institute e della Chinese Academy of Science, hanno scoperto che le mutazioni genetiche alla base della sindrome di Werner, una malattia che porta ad invecchiamento precoce e morte, provocano il deterioramento di fasci di DNA noti come eterocromatina.
” I nostri risultati mostrano che la mutazione nel gene che causa la sindrome di Werner, provoca disorganizzazione dell’ eterocromatina e che questa interruzione del normale “imballaggio” del DNA è un fattore chiave dell’invecchiamento”, spiega Juan Carlos Izpisua Belmonte, autore principale dell’articolo. ” Questo studio ha implicazioni oltre la sindrome di Werner in quanto identifica il meccanismo centrale dell’invecchiamento, la disorganizzazione dell’eterocromatica che ha dimostrato di essere reversibile”.
La malattia di Werner è una sindrome genetica che induce invecchiamento precoce. Le persone affette da questa condizione, soffrono di malattie collegate all’età, come cataratta, diabete di tipo 2, indurimento delle arterie, cancro, osteoporosi, già dai primi anni di vita.
La malattia è causata da una mutazione nel gene WRN che genera la proteina WRN.
Studi precedenti hanno dimostrato che la forma normale della proteina è un enzima che mantiene l’integrità e la struttura del DNA di una persona. Nella sindrome di Werner, la proteina mutata interrompe la replicazione e riparazione del DNA e l’espressione di geni, causando invecchiamento precoce. Tuttavia, ad oggi non era ancora chiaro come questa mutazione interrompe processi cellulari fondamentali.
Nel loro studio, gli scienziati hanno cercato di determinare con precisione come la mutazione della proteina WRN provoca tanto caos cellulare. Per questo, hanno creato un modello cellulare della malattia e utilizzando una tecnologia all’avanguardia gene-editing, hanno eliminato il gene WRN nelle cellule staminali umane.
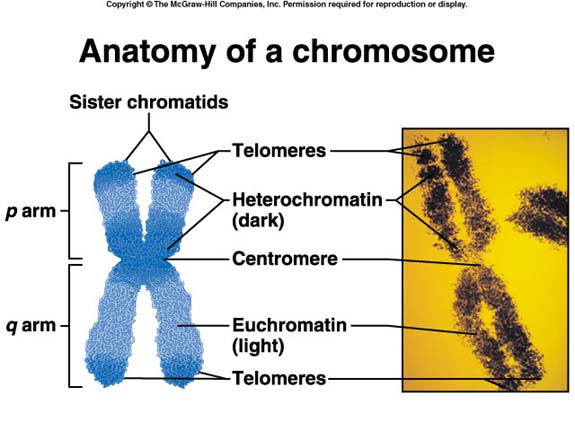
Questo modello di cellule staminali della malattia ha dato agli scienziati la possibilità senza precedenti, di studiare il rapido invecchiamento delle cellule, in laboratorio. Le cellule risultanti hanno riprodotto la mutazione genetica osservata nella sindrome di Werner ed hanno cominciato ad invecchiare più rapidamente del normale. Da un esame più attento gli scienziati hanno scoperto che la delezione del gene WRN provoca interruzione nelle struttura dell’eterocromatina, una parte di DNA presente nel nucleo della cellula.
Questo raggruppamento di DNA agisce come una centralina di controllo dell’attività dei geni e dirige il meccanismo molecolare complesso della cellula. All’esterno dei fasci di eterocromatina ci sono marcatori chimici, noti come tag epigenetici che controllano la struttura dell’eterocromatina. Ad esempio, modifiche di questi interruttori chimici possono modificare l’architettura dell’eterocromatina, portando all’espressione o al silenziamento dei geni.
I ricercatori hanno scoperto che la delezione del gene WRN porta alla disorganizzazione dell’eterocromatina. Ulteriori esperimenti hanno dimostrato che la proteina WRN interagisce direttamente con strutture molecolari note per stabilizzare l’eterocromatina, rivelando per la prima volta che la mutazione nella proteina WRN destabilizza l’eterocromatina.
” Il nostro studio collega la sindrome di Werner alla disorganizzazione dell’eterocromatina e delinea un meccanismo molecolare con cui la mutazione genetica porta allo sconvolgimento generale di processi cellulari, interrompendo la regolazione epigenetica”, dice Izpisua Belmonte. ” Più in generale, la ricerca suggerisce che le alterazioni accumulate nella struttura dell’eterocromatina possono essere una delle principali cause di fondo dell’ invecchiamento cellulare. La scoperta ci pone di fronte alla necessità di trovare un modo per invertire queste alterazioni, per prevenire o addirittura invertire, il declino e le malattie legate all’età”.
Izpisua Belmonte ha aggiunto che saranno necessari ulteriori approfondimenti per comprendere appieno il ruolo della disorganizzazione dell’eterocromatina nell’invecchiamento. E’ necessario capire come interagisce con altri processi cellulari implicati nella maturazione o accorciamento dei telomeri. Inoltre, il team di Izpisua Belmonte sta sviluppando tecnologie di editing epigenetico per invertire le alterazioni epigenetiche con un ruolo nell’invecchiamento umano e nelle malattie.
Video: Researchers May Have Discovered The Mechanisms Behind Aging
Fonte:http://www.salk.edu/news/pressrelease_details.php?press_id=2080