Per la prima volta, un team co-guidato dal ricercatore e Professore della CHU Sainte-Justine presso la Facoltà di Medicina dell’Università di Montréal, Alexey Pshezhetsky, è riuscito a risolvere la struttura unica dell’enzima HGSNAT. La carenza di questo enzima causa la sindrome di Sanfilippo, una rara malattia pediatrica che colpisce il sistema nervoso centrale.
Attraverso la collaborazione con un team dell’Università di Shanghai, la struttura di questo enzima e il meccanismo della sua funzione sono stati rivelati utilizzando la microscopia elettronica criogenica ad alte prestazioni. Questa scoperta consentirà lo sviluppo di nuovi trattamenti per la malattia di Sanfilippo e per altre malattie neurodegenerative mortali simili.
Lo studio è stato pubblicato sulla rivista Nature Structural & Molecular Biology.
Una condizione mortale e complessa
La sindrome di Sanfilippo è una malattia metabolica derivante da mutazioni genetiche che causano l‘accumulo della molecola eparan solfato nelle cellule cerebrali. L’enzima HGSNAT è essenziale per la degradazione dell’eparan solfato. Nella sindrome di Sanfilippo, le mutazioni genetiche di HGSNAT ne impediscono il ripiegamento e il corretto funzionamento. Di conseguenza, l’eparan solfato si accumula, causando la morte neuronale e portando alla demenza nei bambini affetti.
“In termini fondamentali, Sanfilippo è simile al morbo di Alzheimer, ma si manifesta nei bambini di 2 o 3 anni“, ha spiegato il ricercatore Alexey Pshezhetsky, che è anche Professore all’Università di Montréal. “A partire da questa età, lo sviluppo dei bambini affetti ristagna, per poi regredire, fino a scomparire verso la fine dell’adolescenza.”
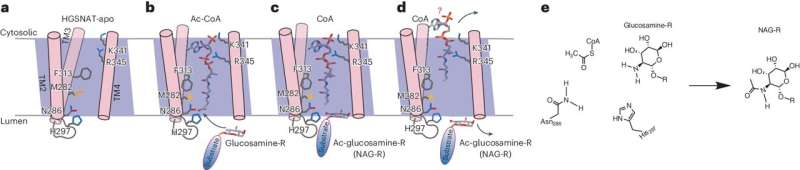
Sebbene attualmente non esista alcun trattamento per questa condizione, molte speranze sono riposte in quella che viene chiamata “terapia chaperone” (CT). La CT prevede la somministrazione di una piccola molecola che si lega all’enzima mutante e lo aiuta a ripiegarsi correttamente, consentendogli di funzionare normalmente.
Per determinare quale molecola è più adatta a legarsi all’enzima, è necessario un modello affidabile della sua struttura, che il team ha sviluppato con successo utilizzando la microscopia elettronica criogenica.
Lo studio apre la strada a nuove cure
In qualità di Presidente della ricerca Elisa Linton sulle malattie lisosomiali, il Professor Alexey Pshezhetsky sta lavorando attivamente per tradurre queste nuove conoscenze in applicazioni cliniche. “In collaborazione con il Professor Christopher Cairo dell’Università di Alberta, stiamo attualmente determinando quali piccole molecole si legano meglio all’enzima e, quindi, sarebbero più efficaci nel trattamento della malattia“, ha aggiunto.
Leggi anche:Sindrome di Door: nuova terapia potrebbe curare malattie rare ed ereditarie
Sono già in corso discussioni con altri ricercatori canadesi per studiare trattamenti che combinino la CT con la terapia genica o con la terapia basata sulle cellule staminali. “La fiducia nell’efficacia di tali approcci combinati sta attualmente crescendo e siamo certi che nei prossimi anni verrà sviluppata una nuova strategia terapeutica a beneficio dei bambini colpiti e delle loro famiglie”, ha concluso.
Immagine Credit Public Domain.