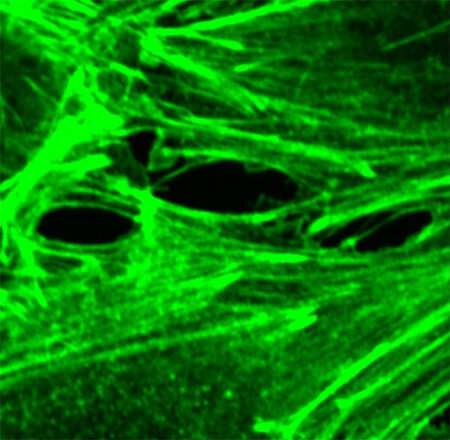
(Sepsi-Immagine:questa immagine, presa al microscopio confocale, mostra un vaso sanguigno. La proteina actina, che aiuta a formare lo scheletro di una cellula, è etichettata in verde. La trombina, un mediatore pro-infiammatorio, provoca lacune tra le cellule della barriera dei vasi sanguigni. Quando il sistema immunitario è iperattivato, come accade nella sepsi, i vasi sanguigni possono perdere e gli organi principali non possono ottenere l’ossigeno e le sostanze nutritive di cui hanno bisogno per sostenere la vita. Credito: Scienze della salute dell’UC San Diego).
La sepsi si verifica quando il corpo lavora così duramente per combattere un’infezione che il sistema immunitario iperattivato danneggia i tessuti del paziente come danno collaterale. Di conseguenza, i vasi sanguigni possono perdere i loro liquidi e gli organi principali non possono ottenere l’ossigeno e le sostanze nutritive di cui hanno bisogno per sostenere la vita. La sepsi è una delle ragioni principali per cui i pazienti, inclusi molti con COVID-19, finiscono nel reparto di terapia intensiva. La condizione è notoriamente difficile da trattare e non esistono farmaci che aiutino a stabilizzare la barriera cellulare che riveste i vasi sanguigni.
I ricercatori della University of California San Diego School of Medicine stanno lavorando per capire meglio come il corpo controlla la permeabilità dei vasi sanguigni e come potrebbero intervenire per ripristinare l’integrità dei vasi sanguigni durante sepsi, traumi o altre condizioni.
Il team ha recentemente scoperto che una proteina chiamata HSP27 svolge un ruolo nella regolazione della perdita dei vasi sanguigni aggiungendo o rimuovono i tag chimici su HSP27.
Vedi anche:Le cellule adipose addominali potrebbero aiutare a combattere la peritonite e la sepsi
Lo studio, pubblicato il 31 agosto 2021 su Science Signaling, fornisce nuovi potenziali bersagli per lo sviluppo di farmaci che sostengono le barriere dei vasi sanguigni, prevenendo la perdita di liquidi.
“Queste nuove informazioni ci aiuteranno a individuare la causa principale della permeabilità dei vasi sanguigni, piuttosto che adottare un approccio ampio che potrebbe avere molti effetti fuori bersaglio”, ha affermato l’autore senior dello studio JoAnn Trejo, Ph.D., Professore di farmacologia e assistente vice cancelliere dell’Ufficio degli affari della facoltà di scienze della salute presso la UC San Diego School of Medicine.
Le barriere dei vasi sanguigni devono essere dinamiche, sufficientemente permeabili da consentire alle cellule immunitarie di fuoriuscire per raggiungere il sito di un’infezione, ad esempio, ma non così permeabili da rendere la situazione pericolosa per la vita. Secondo Trejo, HSP27 si lega alle proteine che aiutano a formare lo “scheletro” della cellula. Lei e i suoi colleghi sospettano che questo sia il motivo per cui l’HSP27 può influenzare la permeabilità dei vasi sanguigni, fortificando lo scheletro delle cellule che mantengono la integra la barriera dei vasi sanguigni.
Trejo ha studiato a lungo i recettori accoppiati a proteine G (GPCR), proteine che sono incorporate nelle membrane cellulari in tutto il corpo, dove agiscono come trasduttori di segnale, consentendo alle cellule di rispondere ai loro ambienti esterni. I GPCR svolgono un ruolo cruciale nella maggior parte delle funzioni biologiche. Circa un terzo di tutti i farmaci terapeutici sul mercato funzionano perché influenzano i segnali GPCR.
Nel loro ultimo studio, il team ha scoperto che durante l’infiammazione, i GPCR dicono agli enzimi chiamati chinasi di aggiungere tag chimici (fosfato) a HSP27. I tag perturbano la struttura di HSP27 in un modo che interrompe le barriere dei vasi sanguigni. Quando HSP27 si riassembla, le barriere si riprendono. I ricercatori hanno convalidato i loro studi di laboratorio sui topi ed hanno scoperto che l’inibizione dell’HSP27 aumenta la perdita dei vasi sanguigni.
La difficoltà nel prendere di mira i GPCR per curare una malattia è il fatto che la maggior parte dei GPCR sono regolatori principali che influenzano diverse funzioni cellulari. L’inibizione di un GPCR può avere molte conseguenze indesiderate. Concentrandosi ulteriormente a valle, mirando non a GPCR principale, ma a bersagli individuali su cui agisce, come HSP27, il team di Trejo spera di consentire lo sviluppo di farmaci stabilizzanti la barriera dei vasi sanguigni che siano più precisi e abbiano meno effetti collaterali negativi.
“È diventato evidente che è possibile sviluppare diverse molecole che possono legarsi al recettore e “distorcerle” – farle segnalare in modo molto specifico rispetto ad alcuni percorsi, ma non ad altri”, ha detto Trejo. “È quello che chiamiamo agonismo di parte, ed è un enorme vantaggio per lo sviluppo di farmaci. Significa che possiamo sviluppare non solo un interruttore on/off, ma un farmaco che può spegnere un recettore o otto diversi tipi di “on”. Vogliamo essere in grado di modificare i percorsi in corso e non toccare gli altri“.
Il team prevede di esplorare ulteriori vie di segnalazione cellulare che aiutino i vasi sanguigni a sviluppare resistenza a lesioni e infiammazioni.