Schizofrenia-Immagine: astratto grafico Credito Cell Genomics (2023)
Geneticamente parlando, siamo individui diversi gli uni dagli altri a causa di lievi variazioni nelle nostre sequenze di DNA, le cosiddette varianti genetiche, alcune delle quali hanno effetti drastici che possiamo vedere e comprendere, dal colore dei nostri occhi al rischio di sviluppare la schizofrenia, una condizione psichiatrica debilitante che colpisce molti milioni di persone in tutto il mondo.
Per diversi anni, gli scienziati hanno studiato l’intero genoma di migliaia di persone con studi di associazione su tutto il genoma o GWAS, per trovare circa 5.000 varianti genetiche associate alla schizofrenia.
Ora, scienziati e colleghi della UNC School of Medicine stanno cercando di capire quali di queste varianti hanno un effetto causale nello sviluppo della schizofrenia. Stanno scoprendo che alcune varianti genetiche regolano o alterano l’espressione dei geni coinvolti nella condizione.
Pubblicata sulla rivista Cell Genomics, questa ricerca segna un grande passo avanti nella comprensione delle basi genetiche della schizofrenia.
“I nostri risultati non solo forniscono informazioni sull’intricato panorama normativo dei geni, ma propongono anche un approccio innovativo per decodificare l’effetto cumulativo delle varianti genetiche sulla regolazione genetica negli individui con schizofrenia”, ha affermato l’autore senior Hyejung Won, Ph.D., Professore di genetica presso la Scuola di Medicina dell’UNC. “Questa comprensione potrebbe potenzialmente aprire la strada a interventi e terapie più precisi in futuro. Al momento, le opzioni terapeutiche sono limitate e alcune persone non rispondono ai farmaci disponibili“.
Per questo studio, Won e i primi autori Jessica McAfee e Sool Lee, entrambi studenti laureati dell’UNC-Chapel Hill, hanno guidato un team di ricercatori dell’UCLA, di Harvard, dell’Università del Michigan e di Human Technopole in Italia, per esplorare le varianti genetiche già legate al rischio di schizofrenia attraverso la ricerca GWAS.
Il loro obiettivo era trovare un modo per distinguere le varianti prive di significato da quelle con un potenziale di attività biologica importante per lo sviluppo della schizofrenia. Ciò non è facile per diversi motivi, uno dei quali è che le varianti genetiche vengono spesso ereditate insieme dai genitori. Quindi, una accanto all’altra potrebbero esserci due varianti genetiche associate alla condizione: una potrebbe essere importante per l’espressione genetica che svolge un ruolo importante nella condizione, ma l’altra variante potrebbe non avere alcun ruolo nella condizione.
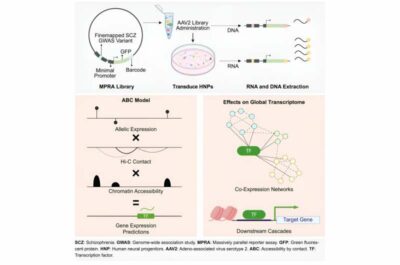
Per affrontare questo problema, i ricercatori hanno utilizzato una tecnica speciale chiamata MPRA (massively parallel reporter assay), essenzialmente una tecnica di sequenziamento genetico in grado di analizzare quali varianti innescano l’espressione genetica e quali no. Per utilizzare questo metodo, i ricercatori hanno introdotto in una piastra le 5.000 varianti nelle cellule cerebrali umane, cellule essenziali per lo sviluppo precoce del cervello.
Queste varianti possono o meno causare l’espressione del loro gene a valle e del codice a barre genetico. Il codice a barre, una sequenza di DNA da 20 bp, è unico per ciascuna variante. Questo è ciò che il gruppo utilizza per distinguere le sequenze varianti. L’MPRA ha rivelato 439 variazioni genetiche con effetti biologici reali, nel senso che possono alterare l’espressione del gene.
“Tradizionalmente, gli scienziati hanno utilizzato altri dati epigenetici, come il legame del fattore di trascrizione e potenziatori definiti biochimicamente, per identificare varianti con effetti biologici“, ha affermato Won. “Tuttavia, questi metodi convenzionali non sono riusciti a prevedere gran parte delle varianti che abbiamo identificato come aventi effetti biologici. Il nostro lavoro indica una ricchezza di varianti inesplorate con effetti biologici“.
Per capire come queste varianti interagiscono per influenzare l’attività genetica, Won e colleghi hanno sviluppato un nuovo modello che combina i dati dell’MPRA con l’architettura della cromatina delle cellule cerebrali, ovvero le informazioni genetiche importanti per il modo in cui è organizzato il DNA delle cellule cerebrali. In questo modo, i ricercatori hanno potuto collegare queste 439 varianti al modo in cui i geni vengono attivati o disattivati.
Leggi anche:La disfunzione mitocondriale può contribuire alla schizofrenia
“La schizofrenia è una condizione complessa altamente ereditabile“, ha detto Won. “Trovare queste 439 varianti potenzialmente causali è un grande passo, ma abbiamo ancora molto lavoro da fare per capire la complicata architettura genetica che porta un individuo a sviluppare questa condizione. Con queste informazioni in mano, potremmo iniziare a comprendere il meccanismo biologico alla base di questo complesso disturbo, che potrebbe eventualmente portare a terapie mirate”.
Fonte:Cell Genomics