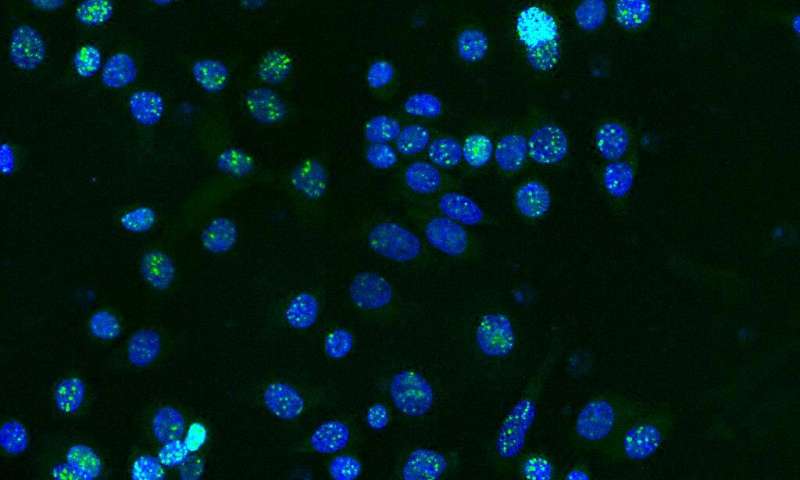
Immagine: danno del DNA accumulato da cellule di carcinoma mammario umano, in risposta ad agenti antitumorali mirati. La diversità genetica generata durante i processi di riparazione del DNA facilita l’evoluzione adattativa e il fallimento terapeutico. Credito: Dr Arcadi Cipponi.
“Le cellule tumorali possono attivare percorsi di copia del DNA soggetti a errori per adattarsi al trattamento del cancro”, ha rivelato uno studio innovativo pubblicato sulla rivista Science.
I batteri usano lo stesso processo, chiamato mutagenesi indotta dallo stress, per sviluppare resistenza agli antibiotici. Le cellule del corpo umano si dividono costantemente e ogni volta è necessario copiare un codice DNA di tre miliardi di lettere con elevata precisione per garantire la sopravvivenza delle cellule. I ricercatori hanno scoperto che la stessa cosa non è vera per i tumori. Un team guidato dal Professor David Thomas del Garvan Institute of Medical Research ha dimostrato come una vasta gamma di tumori, tra cui melanoma, tumore al pancreas, sarcomi e carcinoma mammario, generano un elevato numero di errori quando copiano il loro DNA quando esposti a trattamenti antitumorali, portando alla resistenza ai farmaci.
“La resistenza al trattamento è senza dubbio il problema principale per i pazienti con tumori avanzati, per i quali anche i trattamenti efficaci alla fine falliscono. Abbiamo scoperto una strategia di sopravvivenza fondamentale che le cellule tumorali usano per sviluppare la resistenza e che ci ha fornito nuove possibili strategie terapeutiche”, afferma Professor Thomas, leader del tema della ricerca sul cancro di Garvan e Direttore del Kinghorn Cancer Center.
La resistenza del cancro al trattamento
La resistenza del cancro alla terapia colpisce ogni anno centinaia di migliaia di pazienti affetti da cancro, portando a risultati sanitari devastanti anche per i trattamenti più avanzati. I ricercatori sanno da tempo che le cellule tumorali accumulano variazioni genetiche che consentono loro di eludere il trattamento. Ma come ciò accada – e se il processo possa essere mirato per migliorare il trattamento del cancro – non è ben noto.
Gli autori del presente studio hanno iniziato a studiare i fattori alla base della resistenza al trattamento analizzando i campioni di biopsia di pazienti oncologici, prima e dopo il trattamento con terapie antitumorali mirate. Le terapie mirate bloccano la crescita del cancro interferendo con le molecole necessarie per la crescita del tumore e sono un trattamento comune per molte forme di cancro. I ricercatori sono rimasti sorpresi nello scoprire che le cellule tumorali di pazienti che avevano ricevuto terapie mirate mostravano livelli di danno al DNA molto più elevati rispetto ai campioni pre-trattamento, anche quando questi trattamenti non danneggiavano direttamente il DNA. Inoltre, i ricercatori hanno utilizzato il sequenziamento dell’intero genoma per analizzare in che modo il trattamento ha portato all’evoluzione accelerata del genoma del cancro.
“I nostri esperimenti hanno rivelato che le cellule tumorali esposte a terapie mirate subiscono un processo chiamato mutagenesi indotta dallo stress: generano una variazione genetica casuale a un tasso molto più elevato rispetto alle cellule tumorali non esposte a farmaci antitumorali“, afferma il primo autore dello studio il Dr. Arcadi Cipponi. “Questo processo è antico: gli organismi monocellulari, come i batteri, usano lo stesso processo per evolversi quando incontrano stress nel loro ambiente”.
Vedi anche: Trovato l’ interruttore che disattiva la crescita e le metastasi del cancro al seno triplo negativo
Strategia del cancro in due fasi per la resistenza
Per individuare i meccanismi alla base della mutagenesi indotta dallo stress nelle cellule tumorali umane, i ricercatori hanno realizzato uno schermo su larga scala per mettere a tacere ogni gene nelle cellule tumorali individualmente, cercando di identificare i percorsi specifici che contribuiscono alla resistenza ai farmaci. Quando hanno messo a tacere il gene per MTOR – una proteina del sensore di stress – hanno scoperto che le cellule tumorali hanno smesso di crescere, ma paradossalmente hanno accelerato l’evoluzione in presenza di un trattamento del cancro. “MTOR è una proteina del sensore che dice alle cellule normali di smettere di crescere perché c’è uno stress nell’ambiente. Ma abbiamo scoperto che in presenza di un trattamento del cancro, la segnalazione MTOR ha permesso alle cellule tumorali di cambiare l’espressione dei geni coinvolti nella riparazione e nella replicazione del DNA , ad esempio il passaggio dalle polimerasi ad alta fedeltà, gli enzimi che copiano il DNA, alla produzione di polimerasi soggette a errori “, afferma il Dr. Cipponi. “Ciò ha comportato una maggiore variazione genetica, alimentando in definitiva la resistenza al trattamento”. Il passaggio alla riparazione e alla replicazione del DNA a bassa fedeltà fu temporaneo: una volta che le cellule tumorali acquisivano resistenza a un trattamento per il cancro, riattivavano i percorsi ad alta fedeltà.
“L’instabilità genomica può essere essa stessa dannosa per le cellule, motivo per cui alcune delle nostre chemioterapie e radiazioni terapeutiche funzionano. Abbiamo scoperto che una volta che le cellule tumorali avevano sviluppato resistenza a un trattamento, sono tornate alle DNA polimerasi ad alta fedeltà “, spiega il Dr. Cipponi.
Nuovo approccio per i trattamenti contro il cancro
“La combinazione della terapia convenzionale contro il cancro con farmaci mirati ai meccanismi di riparazione del DNA”, affermano i ricercatori, “può portare a strategie terapeutiche più efficaci”. Come prova di principio, i ricercatori hanno testato una tale combinazione di farmaci in un modello murino di cancro del pancreas. Combinando il trattamento del cancro Palbociclib con Rucaparib, un farmaco che colpisce selettivamente le cellule con ridotta riparazione del DNA, i ricercatori sono stati in grado di ridurre la crescita del cancro di quasi il 60% in 30 giorni, rispetto al solo Palbociclib.
“I nostri risultati hanno portato a nuove potenziali strategie che prevengono la mutagenesi indotta dallo stress nei tumori o sono più efficaci nei tumori che hanno già sviluppato resistenza”, afferma il Professor Thomas.
Fonte: Science