Esteso, il DNA di tutte le cellule del nostro corpo potrebbe raggiungere Plutone. Quindi, come fa ogni piccola cellula a contenere un pacchetto di due metri di DNA nel suo nucleo se è solo un millesimo di millimetro?
La risposta a questo enigma biologico è fondamentale per capire come l’organizzazione tridimensionale del DNA nel nucleo influenza la nostra biologia, da come il nostro genoma orchestra la nostra attività cellulare a come i geni vengono trasmessi dai genitori ai figli.
Nelle cellule umane, 2 m di DNA sono compattate nel nucleo attraverso l’assemblaggio con istoni e altre proteine in strutture cromatiche, domini tridimensionali (3D) di megabase e cromosomi che determinano l’attività e l’ereditarietà dei nostri genomi.
Ora, gli scienziati dell’Istituto Salk e dell’Università della California di San Diego hanno fornito per la prima volta una visione senza precedenti della struttura 3D della cromatina umana – la combinazione di DNA e delle proteine - nel nucleo delle cellule umane vive.
Nello studio, un tour de force descritto in Scienza il 27 luglio 2017, i ricercatori del Salk hanno utilizzato un nuovo colorante del DNA che, associato a una microscopia avanzata in una tecnologia combinata chiamata ChromEMT, consente una visione molto dettagliata della struttura della cromatina nelle cellule a riposo e in stadi mitotici (divisori).
La rivelazione della struttura della cromatica nucleare nelle cellule viventi, può aiutare a riscrivere il modello di testo dell’organizzazione del DNA e anche modificare il nostro approccio a trattamenti per la malattia.
“Una delle sfide più difficili della biologia è quella di scoprire la struttura del DNA nel nucleo e come le sue funzioni sono collegate nel genoma”, afferma il Prof. Clarke O’Shea del Salk e docente all’ Howard Hughes Medical Institute Scholar e autore senior dell’ articolo.
Da quando Francis Crick e James Watson hanno determinato la struttura primaria a doppia elica del DNA, gli scienziati si sono chiesti come il DNA sia ulteriormente organizzato per consentire alla sua intera lunghezza di confluire nel nucleo in modo tale che la cellula potesse produrne delle copie e accedere ad esso in diversi punti del suo ciclo di attività. I raggi X e la microscopia hanno dimostrato che il livello primario di organizzazione della cromatina prevede 147 basi di spooling del DNA intorno alle proteine per formare particelle di circa 11 nanometri (nm) di diametro denominate nucleosomi. Queste “perline di nucleosoma” sono quindi organizzate per piegarsi in fibre di diametro in aumento (30, 120, 320 nm ecc.), fino a formare i cromosomi.
Per superare il problema della visualizzazione della cromatina in un nucleo intatto, la squadra di O’Shea ha proiettato un certo numero di coloranti candidati e alla fine ne ha individuato uno che può essere manipolato con precisione con la luce per subire una complessa serie di reazioni chimiche che avrebbero sostanzialmente “verniciato” la superficie del DNA in modo che la sua struttura locale e l’organizzazione del polimero 3D potessero essere rappresentati in una cellula vivente. Il team ha collaborato con l’esperto di microscopia Professore Mark Ellisman dell’Università della California, San Diego, uno dei coautori dell’ articolo, per sfruttare una forma avanzata di microscopia elettronica che fissa i campioni in un fascio di elettroni che consente di ricostruire la loro struttura 3D. La squadra di O’Shea ha definito la tecnica che combina il colorante della cromatina con la Chrom EMT.
Il team ha utilizzato la ChromEMT per l’immagine e la misurazione della cromatina nelle cellule umane riposanti e durante la divisione cellulare (mitosi), quando il DNA è compattato nella sua forma più densa – le 23 coppie di cromosomi mitotici che rappresentano l’immagine iconica del genoma umano. Sorprendentemente, i ricercatori non hanno osservato nessuna delle strutture di ordine superiore del modello dei libri di testo, da nessuna parte.
“Il modello del libro di testo è un’illustrazione da fumetto per una ragione”, dice Horng Ou, un socio di ricerca Salk e primo autore dell’ articolo. “La cromatina estratta dal nucleo e sottoposta a trasformazione in vitro nei tubi di prova, non può rappresentare la cromatina di una cellula intatta, quindi è estremamente importante poterla vedere dal vivo”.
Quello che il team di O’Shea ha visto, sia nelle cellule a riposo che in divisione, era la cromatina le cui “perline su una corda” non costituivano una struttura di ordine superiore come teorizzao di 30 o 120 o 320 nanometri, ma formava una catena semi-flessibile, misurata accuratamente e variabile continuamente lungo la sua lunghezza tra soli 5 e 24 nanometri, piegando e flettendosi per ottenere diversi livelli di compattazione.
Ciò suggerisce che è la densità di imballaggio della cromatina, e non una struttura di ordine superiore, che determina quali aree del genoma sono attive e soppresse.
Con le loro ricostruzioni di microscopia 3D, la squadra è stata in grado di muoversi in un volume di torsioni e rotazioni della cromatina di 250 nm x 1000 nm x 1000 nm e prevedere come una grande molecola come l’ RNA polimerasi, che trascrive copie del DNA, potrebbe essere diretta dalla densità di imballaggio variabile della cromatina, ” come un velivolo del videogiochi che vola attraverso una serie di canyon, in un punto particolare del genoma“.
I risultati dello studio suggeriscono che il controllo dell’accesso alla cromatina potrebbe essere un approccio utile per prevenire, diagnosticare e curare malattie come il cancro.
In conclusione i ricercatori sostengono che la cromatina è una catena granulare flessibile e disordinata di diametro da 5 a 24 nm che viene confezionata a diverse densità di concentrazione nei nuclei interfasi e nei cromosomi mitotici. La struttura primaria complessiva dei polimeri di cromatina non cambia nei cromosomi mitotici e questo aiuta a spiegare la rapida dinamica della condensazione della cromatina e come le interazioni epigenetiche e le strutture possono essere ereditate attraverso la divisione cellulare. A differenza di fibre rigide che hanno lunghe lunghezze di persistenza fisse, le catene cromatiniche disordinate da 5 a 24 nm sono flessibili e possono piegarsi a varie lunghezze per ottenere diversi livelli di compattazione e densità di imballaggio elevate. La diversità delle strutture di cromatina è emozionante e fornisce una base strutturale per come diverse combinazioni di sequenze di DNA, interazioni, lunghezze di linker, varianti di istone e le modifiche possono essere integrate per ottimizzare la funzione del DNA genomico nel nucleo, per specificare il destino cellulare. I dati suggeriscono inoltre che l’assemblaggio di domini 3D nel nucleo con concentrazioni di cromatina diverse, piuttosto che piegatura di ordine superiore, determina l’accessibilità globale e l’attività del DNA.
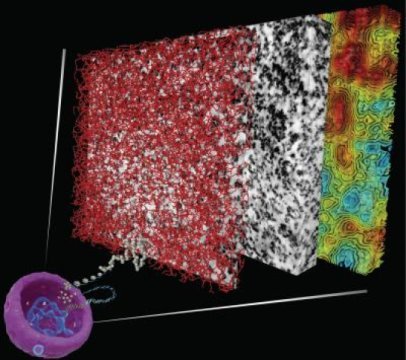
Le quantità di campione di EMT-DNA-nucleosomi sono nere. La cromatina è una catena granulare strutturalmente disordinata da 5 a 24 nm che viene confezionata in diverse densità 3D CVC nei nuclei interfasi umani e nei cromosomi mitosi (rosso, alta densità, giallo, densità media, blu, bassa densità).
“Mostriamo che la cromatina non ha bisogno di formare strutture discrete di ordine superiore per adattarsi al nucleo”, aggiunge O’Shea. “È la densità di impacchettamento che potrebbe cambiare e limitare l’accessibilità della cromatina, fornendo una base strutturale locale e globale attraverso la quale diverse combinazioni di sequenze di DNA, variazioni nucleosomi e modifiche, potrebbero essere integrate nel nucleo per perfezionare squisitamente l’attività funzionale e l’accessibilità dei nostri genomi “.
Il lavoro futuro esaminerà se la struttura del cromatina è universale tra i tipi di cellule o anche tra gli organismi.
Fonte: Science