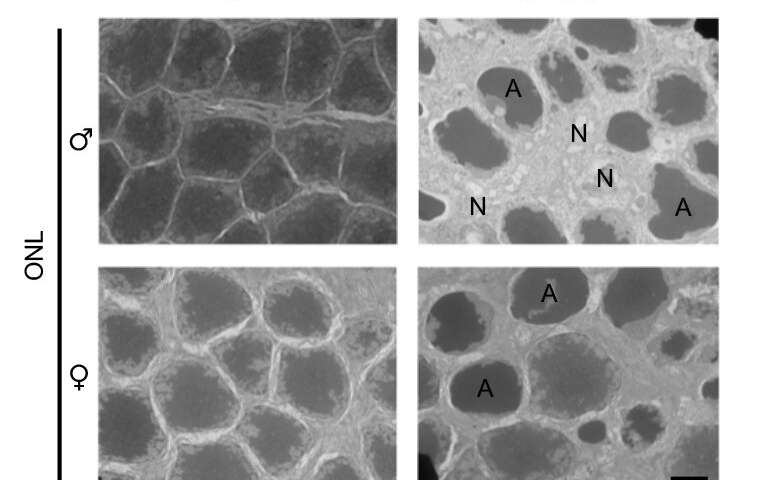
Immagini al microscopio elettronico di cellule fotorecettrici in topi maschi e femmine. Il trattamento con la chemioterapia alchilante MMS ha causato la degenerazione della retina e aumentato la morte delle cellule dei fotorecettori (colonna destra). Credito: M. Allocca et al., Science Signaling (2018).
Gli enzimi di riparazione del DNA aiutano le cellule a sopravvivere al danno al loro genoma che si presenta come normale sottoprodotto dell’attività cellulare e può anche essere causato da tossine ambientali. Tuttavia, in determinate situazioni, la riparazione del DNA può diventare dannosa per le cellule, provocando una risposta infiammatoria che provoca gravi danni ai tessuti.
La Prof.ssa del MIT Leona Samson ha ora dimostrato che l’infiammazione è un componente chiave del modo in cui questo danno si verifica nelle cellule dei fotorecettori nelle retine dei topi. Circa 10 anni fa, lei e i suoi colleghi hanno scoperto che l’attivazione iperattiva dei sistemi di riparazione del DNA può portare a danni alla retina e cecità nei topi. L’enzima chiave in questo processo, noto come glicosilasi Aag, può anche causare danni in altri tessuti quando diventa iperattivo.
“È un altro caso in cui, nonostante il fatto che l’infiammazione è lì per proteggerti, in alcune circostanze l’enzima quando è iperattivo, può essere davvero dannoso”, dice Samson, Professore emerito di biologia e ingegneria biologica e autore senior dello studio.
La glicosilasi Aag aiuta a riparare il danno al DNA causato da una classe di farmaci noti come agenti alchilanti che sono comunemente usati come farmaci chemioterapici e si trovano anche in sostanze inquinanti come fumo di tabacco e gas di scarico. “Danni retinici da questi farmaci non sono stati osservati nei pazienti umani, ma gli agenti alchilanti possono produrre danni simili in altri tessuti umani”, dice Samson. Il nuovo studio, che rivela come l’iperattività di Aag conduce alla morte cellulare, suggerisce possibili bersagli per farmaci che potrebbero prevenire tale danno.
Mariacarmela Allocca, ex postdoc del MIT, è l’autore principale dello studio che appare nel numero del 12 febbraio di Science Signaling. Anche l’assistente tecnico del MIT Joshua Corrigan, l’ex postdoc Aprotim Mazumder e l’ex assistente tecnico Kimberly Fake sono autori del documento.
Un circolo vizioso
In uno studio del 2009, Samson e i suoi colleghi hanno scoperto che un livello relativamente basso di esposizione ad un agente alchilante portava a tassi di danno retinico molto alti nei topi. Gli agenti alchilanti producono specifici tipi di danno al DNA e la glicosilasi Aag avvia normalmente la riparazione di tale danno. Tuttavia, in certi tipi di cellule che hanno livelli più alti di Aag, come i fotorecettori del topo, l’iperattività dell’enzima innesca una catena di eventi che alla fine portano alla morte cellulare.
Nel nuovo studio, i ricercatori hanno voluto scoprire esattamente come ciò avvenga. Sapevano che Aag era iperattivo nelle cellule colpite, ma non sapevano esattamente in che modo avrebbe portato alla morte delle cellule o quale tipo di morte cellulare stava avvenendo. Inizialmente i ricercatori sospettavano che si trattasse di apoptosi, un tipo di morte cellulare programmata in cui una cellula morente viene gradualmente scomposta e assorbita da altre cellule.
Tuttavia, hanno presto trovato la prova che un altro tipo di morte cellulare chiamata necrosi rappresenta la maggior parte del danno. Quando Aag inizia a cercare di riparare il danno al DNA causato dall’agente alchilante, elimina così tante basi del DNA danneggiate che iperattivano un enzima chiamato PARP, che induce la necrosi. Durante questo tipo di morte cellulare, le cellule si rompono e fuoriesce il loro contenuto che avverte il sistema immunitario che qualcosa non va.

Una delle proteine secrete dalle cellule morenti, nota come HMGB1, stimola la produzione di sostanze chimiche che attraggono le cellule immunitarie chiamate macrofagi, che penetrano specificamente nello strato fotorecettore della retina. Questi macrofagi producono molecole di ossigeno altamente reattive che creano più danni e rendono l’ambiente ancora più infiammatorio. Questo a sua volta causa più danni al DNA, che è riconosciuto da Aag.
Vedi anche, La riparazione difettosa del danno del DNA conduce al caos nel genoma.
“Ciò peggiora la situazione, perché la glicosilasi Aag agisce sulle lesioni prodotte dall’infiammazione, quindi si ottiene un circolo vizioso e la riparazione del DNA causa sempre più degenerazione e necrosi nello strato di fotorecettori“, afferma Samson.
Nulla di ciò accade nei topi che mancano di Aag o di PARP e non si verifica in altre cellule dell’occhio o nella maggior parte degli altri tessuti corporei.
“Mi stupisce che le altre cellule nella retina non sono affatto interessate dai danni al DNA, quindi una possibilità è che forse non esprimono Aag, mentre le cellule dei fotorecettori lo fanno “, dice Samson.
“Questi studi molecolari sono eccitanti, in quanto hanno contribuito a definire la fisiopatologia sottostante associata al danno retinico“, afferma Ben Van Houten, Professore di farmacologia e biologia chimica presso l’Università di Pittsburgh, che non è stato coinvolto nello studio. “La riparazione del DNA è essenziale per l’eredità fedele del materiale genetico di una cellula, tuttavia l’azione di alcuni enzimi di riparazione del DNA può determinare la produzione di intermedi tossici che esacerbano l’esposizione ad agenti genotossici”.
Effetti variabili
I ricercatori hanno anche scoperto che l’infiammazione e la necrosi della retina erano più gravi nei topi maschi rispetto ai topi femmina e sospettano che l’estrogeno, che può interferire con l’attività di PARP, possa aiutare a sopprimere il percorso che porta all’infiammazione e alla morte cellulare.
Il laboratorio di Samson ha già scoperto che l’attività di Aag può anche esacerbare i danni al cervello durante un ictus, nei topi. Lo stesso studio ha rivelato che l’attività di Aag peggiora anche l’infiammazione e i danni ai tessuti nel fegato e nei reni dopo la privazione dell’ossigeno. La morte cellulare causata da Aag è stata osservata anche nel cervelletto del topo e in alcune cellule del pancreas e del midollo osseo.
Gli effetti della iperattività di Aag sono stati poco studiati negli esseri umani, ma ci sono prove che individui sani hanno livelli molto diversi dell’enzima, suggerendo che potrebbe avere effetti diversi in persone diverse.
“Presumibilmente ci sono alcuni tipi di cellule nel corpo umano che risponderebbero allo stesso modo dei fotorecettori dei topi”, dice Samson. “Potrebbero non essere lo stesso insieme di cellule .”
Fonte, Science