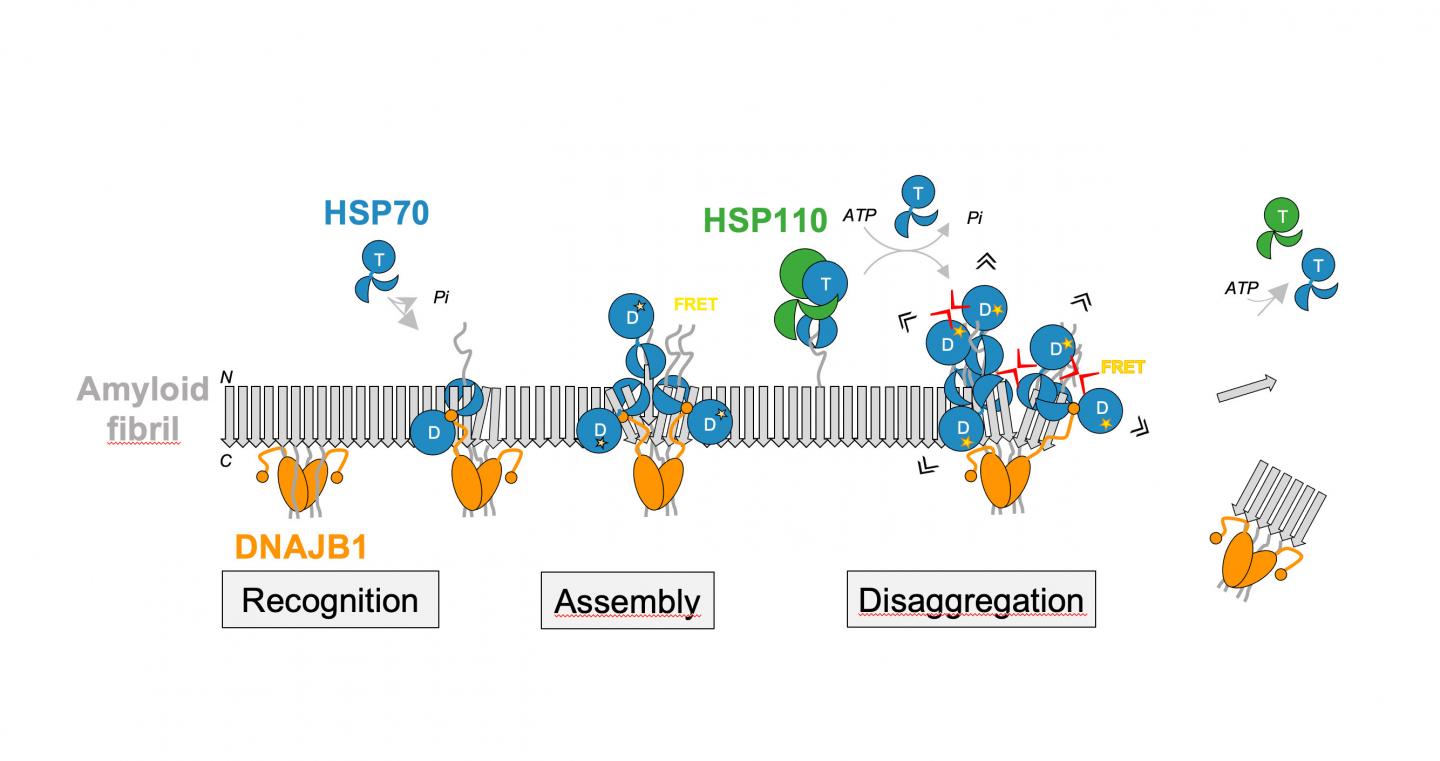
Immagine:la disaggregazione delle fibrille amiloidi dell’α-sinucleina si basa sulla collaborazione del chaperone HSP70 con i co-chaperoni DNAJB1 e HSP110. Questa collaborazione garantisce il riconoscimento delle fibrille, seguito dal corretto assemblaggio del macchinario di disaggregasi Hsp70 sulla superficie delle fibrille consentendo così una disaggregazione produttiva. Credit: Bernd Bukau / Università di Heidelberg.
In molte malattie neurodegenerative come il Parkinson, gli aggregati proteici si formano nel cervello e si presume contribuiscano alla morte delle cellule neuronali.
Eppure esiste un meccanismo di difesa cellulare che contrasta questi aggregati, noti come fibrille amiloidi e può persino dissolvere le fibrille già formate. Questo meccanismo di difesa si basa sull’attività dei chaperoni molecolari, cioè gli aiutanti del ripiegamento delle proteine, della famiglia delle proteine da shock termico 70 (Hsp70). I biologi molecolari dell’Università di Heidelberg e del Centro tedesco per la ricerca sul cancro hanno studiato in che modo il sistema Hsp70 disaggrega le fibrille amiloidi della proteina α-sinucleina specifica del Parkinson in una provetta. Il team di ricerca guidato dal Prof. Dr Bernd Bukau si aspetta che i risultati della ricerca forniscano nuove informazioni su come si sviluppa la malattia di Parkinson e su cosa si potrebbe fare per influenzarla.
Lo studio è stato pubblicato su Natura.
Le proteine in tutte le cellule, dai batteri all’uomo, devono piegarsi al loro stato nativo. Le catene di blocchi di amminoacidi assumono strutture tridimensionali specifiche che conferiscono alle proteine la loro funzionalità. Questo stato di piegatura corretta è costantemente minacciata da influenze esterne ed interne che possono portare a proteine piegate in modo errato e quindi danneggiate. Esiste il rischio che le proteine danneggiate si “aggreghino” in filamenti più lunghi, le fibrille amiloidi. Questo accade con l’α-sinucleina nella malattia di Parkinson, per esempio. Le fibrille, a loro volta, sono il punto di partenza per depositi ancora più grandi. “Il processo di formazione di tali aggregati fibrillari può danneggiare le cellule e persino portare alla morte cellulare, come nel caso di malattie neurodegenerative come il Parkinson e l’Alzheimer”, spiega il Prof. Bukau.
Ve
La ricerca del Prof. Bukau si concentra su come questi aggregati proteici possono essere sciolti. In un lavoro precedente, lui e il suo team sono riusciti a identificare un’attività cellulare che svolge un ruolo vitale nella dissoluzione degli aggregati fibrillari, che si basa sugli accompagnatori della famiglia Hsp70. Chaperoni Hsp70 aiutano altre proteine a piegarsi e possono persino isolare e ripiegare le proteine aggregate. L’ultima ricerca del Prof.Bukau e della Dr.ssa Anne Wentink mostra gli effetti che chaperoni Hsp70 hanno sulle fibrille amiloidi specifiche del Parkinson della proteina α-sinucleina.
Vedi anche:Parkinson o NIID? Stesse mutazioni genetiche trovate in entrambe le condizioni
L’α-sinucleina è una piccola proteina che aiuta nel rilascio di messaggeri chiamati neurotrasmettitori nel cervello, sebbene la sua esatta funzione rimanga poco chiara. È nota perché massicci depositi di questa specifica proteina sono stati trovati nei pazienti con Parkinson ed è stato causalmente collegato alla malattia.
In esperimenti biochimici, gli scienziati di Heidelberg sono stati recentemente in grado di dimostrare che il chaperone umano Hsp70 si affida all’assistenza di due specifici partner co-chaperoni per dissolvere le fibrille amiloidi della proteina α-sinucleina. Un’interazione precisamente regolata di queste proteine porta alla formazione di complessi di chaperoni sulla superficie delle fibrille, che poi rompono gli aggregati. “È il puro e semplice accumulo locale di molte proteine chaperone sulla superficie delle fibrille di α-sinucleina che genera la forza per rompere le fibrille e staccare le molecole di α-sinucleina”, spiega il Dott. Wentink. La stretta vicinanza tra chaperoni sulla superficie ristretta delle fibrille gioca un ruolo decisivo nella creazione di forze di trazione sufficientemente forti da interrompere le fibrille.
Gli esperimenti sono stati condotti insieme ai colleghi dell’European Molecular Biology Laboratory (EMBL) di Heidelberg, del Centre for Structural Biology di Montpellier (Francia) e dell’École Polytechnique Fédérale de Lausanne (Svizzera). Il progetto è stato finanziato dal programma “Top Research” della Baden-Württemberg Foundation, della German Research Foundation e dell’Associazione Helmholtz.
Il secondo studio pubblicato su Nature si concentra su un meccanismo di regolazione precedentemente sconosciuto, un tipo di interruttore molecolare che mette in moto l’attività complessiva di chaperone Hsp70 per dissolvere le fibrille amiloidi. Questo meccanismo si basa su una sequenza di interazioni dirette tra le diverse parti del co-chaperone DNAJB1 e chaperone Hsp70. Questo alla fine attiva l’Hsp70 per utilizzare l’ATP come fonte di energia, rendendo possibile il legame produttivo alle fibrille e la loro disintegrazione. Una stretta collaborazione di ricerca della Dott.ssa Rina Rosenzweig del Weizman Institute of Science di Rehovot (Israele) e del Prof.Bukau, del Dottor Wentink e del Dottor Nadinath Nillegoda della Monash University di Melbourne (Australia) – ex borsista della Fondazione Alexander von Humboldt nella ricerca del Bernd Bukau gruppo – è riuscita a identificare questo meccanismo.
“I nostri ultimi risultati dei due studi ci danno una comprensione molecolare di come si sciolgono le fibrille amiloidi. Siamo stati in grado di dimostrare che i chaperoni funzionano come una macchina per dissolvere le fibrille”, aggiunge il Prof. Bukau. Secondo il ricercatore di Heidelberg, questo studio apre nuove strade per lo sviluppo di agenti che prendono di mira specificamente il meccanismo di difesa cellulare basato sui chaperoni contro la formazione di amiloide. Una migliore comprensione di come questa attività dei chaperoni influenzi il decorso delle malattie neurodegenerative sarà quindi di fondamentale importanza nello sfruttamento terapeutico dei risultati descritti in questi studi.
Fonte:Nature