Pensate alla proteina BH3 come a un dito che spegne un interruttore di sopravvivenza delle cellule cancerogene del melanoma. Il problema è che la maggior parte delle cellule tumorali trova il modo di rimuovere questo “dito”, interrompendo l’azione di un gene chiamato p53 che mette in movimento il dito BH3.
Ora pensate a Bcl-2 come all’interruttore stesso. Quando il cancro blocca p53, il dito BH3 non si muove mai e l’interruttore di sopravvivenza Bcl-2 rimane acceso. Nonostante migliaia di studi pubblicati, i ricercatori non hanno avuto molta fortuna nel proteggere direttamente l’azione di p53, ma BH3 è un’altra storia.
Esistono farmaci che imitano l’azione di BH3, chiamati collettivamente (in modo creativo …) “mimetici di BH3”. Ad esempio, il farmaco venetoclax è un mimetico BH3 che ha ottenuto l’approvazione della FDA contro un tumore del sangue.
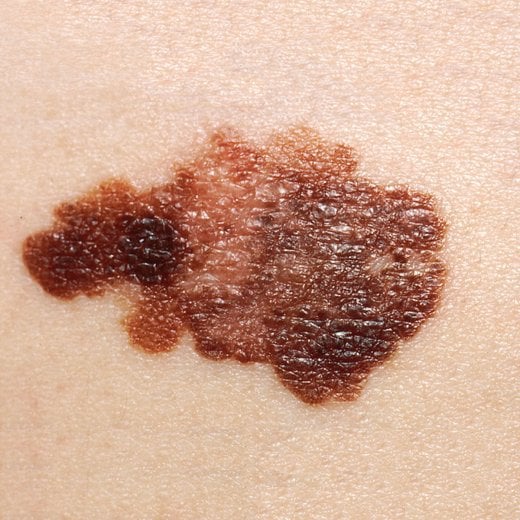
I mimetici di BH3 sono anche riusciti in laboratorio a combattere contro la pericolosa forma di cancro della pelle, il melanoma. Ma a differenza dei tumori del sangue, sembra che il melanoma abbia un modo subdolo per aggirare i mimetici di BH3.
Ora, uno studio della University of Colorado Cancer Center, Dipartimento di Dermatologia, pubblicato sulla rivista Cell Death and Disease, mostra come il melanoma sfugge ai mimetici di BH3 esistenti e suggerisce una nuova strategia per bloccare questa via di fuga.
Il problema è che Bcl-2 non è l’unico interruttore che se lasciato in posizione “on” mantiene in vita le cellule cancerogene e anche quando Bcl-2 stesso viene disattivato, le cellule di melanoma possono ottenere segnali di sopravvivenza ugualmente efficaci da un altro membro della famiglia BCL-2, vale a dire la proteina MCL-1.
Lo studio corrente si è chiesto cosa sarebbe successo se entrambi questi interruttori fossero stati disattivati contemporaneamente.
Quando il gruppo ha usato navitoclax, per mettere a tacere Bcl-2 insieme al farmaco sperimentale A-1210477 per mettere a tacere l’MCL-1, le cellule del melanoma sono morte. Non solo la combinazione di navitoclax e A-1210477 ha ucciso le cellule di melanoma e campioni di pazienti con melanoma indipendentemente dalle mutazioni specifiche che guidavano la malattia o se il paziente aveva ricevuto trattamenti precedenti, ma la combinazione ha ucciso anche le cellule che iniziavano a sviluppare il melanoma (cioè cellule staminali cancerose ) che spesso resistono al trattamento per causare recidive della malattia.
( Vedi anche:Melanoma: scoperto un meccanismo epigenetico collegato alla resistenza ai farmaci).
“Nelle cellule tumorali c’è un mix di proteine pro-morte e anti-morte. A seconda del loro equilibrio, queste cellule vivono o muoiono. Usando navitoclax e A-1210477 per silenziare Bcl-2 e MCL-1, rimuoviamo le proteine dell’ anti morte e, a conti fatti, le cellule tumorali muoiono “, dice la prima autrice, Nabanita Mukherjee, ricercatrice associata al Dipartimento di Dermatologia della CU School of Medicine.
Il lavoro è stato pubblicato dai laboratori del Drs. David Norris e Yiqun Shellman.
Oltre a Bcl-2 e MCL-1, c’ è un terzo genitore in questa storia del “survival switch” della famiglia BCL-2. Nel cancro al seno, DRP-1 produce proteine di morte. Ma, lo studio attuale mostra che nel melanoma, DRP-1 ha l’effetto opposto, producendo proteine anti-morte. La combinazione di navitoclax e A-1210477 ha agito contro DRP-1. Inoltre, quando il gruppo ha usato CRISPR / Cas9 per disattivare completamente DRP-1, le cellule di melanoma sono state uccise in modo ancora più efficiente.
“Questa scoperta ed i nostri risultati suggeriscono che l’inibizione di DRP-1 coopera con la terapia mimetica BH3 nel melanoma“, dice Mukherjee.
“Sebbene i trattamenti per il melanoma siano progrediti drasticamente, sono ancora necessarie opzioni alternative, soprattutto per i pazienti che non rispondono o ricadono dalle attuali terapie o immunoterapie”, afferma Mukherjee. “I nostri studi suggeriscono che il concetto di target per più membri della famiglia BCL-2 merita di essere ulteriormente esplorato per questi pazienti“.