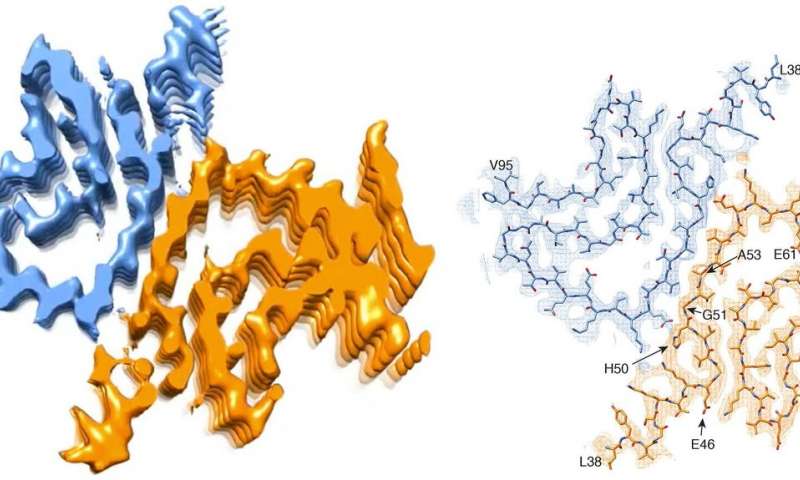
Immagine: Sezione trasversale di una fibrilla alfa-sinucleina. A sinistra: ricostruzione 3D della fibrilla, che mostra due molecole proteiche interagenti. A destra: modello atomico della struttura fibrillare. Credito: Universität Basel.
La malattia di Parkinson è stata descritta per la prima volta da un medico britannico più di 200 anni fa. Le cause esatte di questa malattia neurodegenerativa sono ancora sconosciute. In uno studio recentemente pubblicato su eLife, un team di ricercatori guidato dal Prof. Henning Stahlberg del Biozentrum dell’Università di Basilea ha messo in discussione la precedente comprensione di questa malattia.
( Vedi anche:La stimolazione cerebrale profonda può rallentare la progressione del tremore nel Parkinson).
Le braccia e le gambe tremano, i muscoli diventano più deboli e i movimenti più lenti – questi sono i sintomi tipici di molti pazienti affetti da morbo di Parkinson che colpisce più di 6 milioni di persone in tutto il mondo. In questi pazienti, le cellule nervose produttrici di dopamina nel cervello si estinguono lentamente. La conseguente mancanza di questo neurotrasmettitore compromette la funzione motoria e spesso influisce anche sulle capacità cognitive.
Interessante: le fibrille proteiche causano il morbo di Parkinson
È stato ipotizzato che la proteina alfa-sinucleina sia uno dei fattori scatenanti. Questa proteina può aggregarsi e formare piccoli aghi, le cosiddette fibrille, che si accumulano e si depositano come corpi di Lewy nelle cellule nervose. Queste fibrille tossiche danneggiano le cellule cerebrali colpite. Un gruppo di scienziati guidati dal Prof. Henning Stahlberg del Biozentrum dell’Università di Basilea, in collaborazione con ricercatori della Hoffmann-La Roche Ltd. e dell’ETH di Zurigo, ha ora generato artificialmente una fibrilla alfa-sinucleina in provetta. I ricercatori sono stati in grado di visualizzare per la prima volta la sua struttura tridimensionale con risoluzione atomica. “Contrariamente alle nostre aspettative, i risultati sembrano sollevare molte più domande di quante potevamo aspettarci”, afferma Stahlberg.
È importante sapere che in alcune forme congenite della malattia di Parkinson, le persone affette presentano difetti genetici nel gene dell’alfa-sinucleina. Queste mutazioni, si sospetta, inducono alla fine la proteina a ripiegarsi in modo errato, formando così le pericolose fibrille. “Tuttavia, la nostra struttura tridimensionale rivela che una proteina alfa-sinucleina mutata non dovrebbe essere in grado di formare questo tipo di fibrille”, afferma Stahlberg. “A causa della loro posizione, la maggior parte di queste mutazioni ostacolerebbero la formazione della struttura fibrillare che abbiamo trovato“. In breve, se la struttura della fibrilla provoca la malattia di Parkinson, il difetto genetico dovrebbe proteggere dalla malattia. Ma non è così.
Ora sono necessarie ulteriori indagini per comprendere questa struttura fibrillare. Quali sono gli effetti delle mutazioni dell’alfa-sinucleina? Conducono a forme distinte di aggregati proteici? Qual’ è il ruolo delle fibrille nelle cellule nervose e perché queste cellule muoiono? Ad oggi, l’esatta funzione fisiologica dell’alfa-sinucleina non è ancora nota. Poiché solo i sintomi di questa malattia neurodegenerativa possono essere alleviati con i farmaci attuali, sono urgentemente necessarie nuove ipotesi.
Fonte: eLife