Immagine: Chip microfluidico OEK sviluppato per rilevare metastasi peritoneali e capacità della membrana cellulare. Credito: ZHANG Yuzhao et al.
ll carcinoma gastrico è il quinto tumore più frequentemente diagnosticato e la terza causa di morte per cancro in tutto il mondo, con oltre 1 milione di nuovi casi e quasi 800.000 decessi all’anno.
Nonostante i miglioramenti nel trattamento, la prognosi per i pazienti con carcinoma gastrico è ancora insoddisfacente, specialmente per i pazienti che soffrono di metastasi peritoneale. Si ritiene che l’impianto di cellule tumorali gastriche libere nella cavità peritoneale causi metastasi peritoneale, che è la via più comune di diffusione del tumore nel cancro gastrico. La prognosi infausta delle metastasi peritoneali è in gran parte dovuta alla difficoltà nella diagnosi precoce. Nel complesso, la separazione e la caratterizzazione delle cellule tumorali sono essenziali per la diagnosi precoce delle metastasi peritoneali. Nella pratica clinica, vengono eseguiti esami citologici di ascite e lavaggi peritoneali per rilevare le cellule tumorali libere nella cavità peritoneale. Tuttavia, è difficile per i patologi distinguere le cellule del cancro gastrico dalle cellule mesoteliali peritoneali (i componenti principali dell’ascite e del lavaggio peritoneale). Come le cellule tumorali, le cellule mesoteliali peritoneali sono di origine epiteliale e possono mostrare caratteristiche simili. Inoltre, a questo metodo convenzionale manca anche la sensibilità, poiché è difficile identificare le poche cellule cancerose tra un gran numero di cellule. Inoltre, l’esame citologico si basa sulla colorazione cellulare, che richiede tempo e non fornisce cellule vive per un ulteriore utilizzo. Allo stesso tempo, la somiglianza tra il cancro e le cellule mesoteliali limita anche l’uso di alcuni metodi avanzati come CellSearch, che si basa su produttori epiteliali per etichettare e separare le cellule tumorali circolanti nei campioni di sangue. Pertanto, è urgente la necessità di un nuovo metodo diagnostico, privo di etichetta, che consenta di risparmiare tempo e in grado di distinguere e separare le cellule tumorali gastriche vive con elevata sensibilità.
Lo studio è stato pubblicato su Science Advances il 5 agosto.
L’istituzione di nuovi meccanismi fisici ha portato a scoperte nella separazione cellulare nell’ingegneria biomedica. Le tecnologie di microfluidica sono utilizzate per controllare, manipolare e analizzare con precisione i fluidi attraverso microcanali deliberatamente progettati. Diverse forme di sistemi microfluidici sono stati fabbricati per purificare cellule del sangue, esosomi e dei neutrofili. Altri sistemi sono stati sviluppati per separare i globuli rossi, i globuli bianchi e le linee cellulari tumorali (HepG2, SKBR3, A549 e BGC823) dai campioni di sangue. Nonostante i vantaggi della separazione automatica e continua delle cellule, i sistemi microfluidici richiedono progetti e processi di fabbricazione complicati e mancano di operazioni interattive all’interno del chip microfluidico. Pertanto, l’integrazione di altre tecnologie di micro / nanomanipolazione controllabili all’interno di sistemi microfluidici è altamente favorevole per la separazione cellulare e questo riduce anche la domanda del design del microcanale. Ad esempio, i sistemi integrati di pinzette ottiche e chip microfluidici sono stati utilizzati per purificare rapidamente cellule di mammiferi, cellule di lievito e cellule embrionali umane. Gli array personalizzati di magneti permanenti sono stati combinati con la microfluidica per separare i globuli bianchi dal sangue umano intero. Non vi è dubbio che queste tecniche possono essere applicate alla separazione cellulare con alti tassi di purificazione e recupero. Tuttavia, le pinzette ottiche richiedono costose apparecchiature laser, che potrebbero causare danni alla foto e influire sull’attività cellulare; d’altra parte, le pinzette acustiche e il DEP richiedono elettrodi fisici predefiniti che aumenteranno la complessità del sistema riducendo la flessibilità del sistema e il tempo. Idealmente, la rapida separazione delle cellule viventi e l’estrazione senza etichetta delle caratteristiche intrinseche dei campioni sono essenziali per la diagnosi precoce delle metastasi peritoneali nel cancro gastrico.
Vedi anche:Carcinoma gastrico: studio internazionale dimostra efficacia di nuovi farmaci
Riferiscono gli autori:
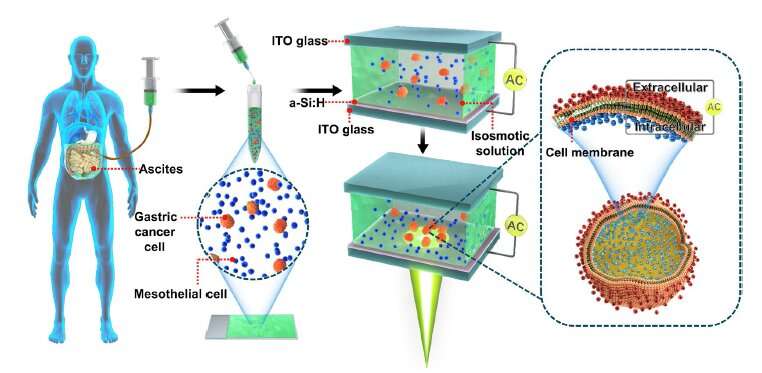
“Il rilevamento di cellule tumorali gastriche libere nei lavaggi peritoneali e nell’ascite svolge un ruolo vitale nel trattamento del cancro gastrico. Tuttavia, a causa del basso contenuto di cellule tumorali nei lavaggi peritoneali dei pazienti, i metodi di rilevamento tradizionali mancano di sensibilità e non possono soddisfare la domanda clinica. In questo studio, abbiamo utilizzato un metodo microfluidico elettrocinetico indotto otticamente (OEK) per la separazione e la caratterizzazione senza etichetta delle cellule tumorali gastriche del paziente. Questo metodo ha mostrato un’elevata efficacia e sensibilità. Abbiamo separato con successo le cellule tumorali da una miscela di lavaggio peritoneale simulato di linee cellulari di cancro gastrico e cellule di lavaggio peritoneale in un rapporto di 1: 1000. Abbiamo separato ulteriormente le cellule tumorali gastriche dall’ascite di sei pazienti con purezza fino al 71%. Inoltre, abbiamo misurato le capacità della membrana cellulare, che può essere utilizzata come biomarcatore per le cellule tumorali gastriche. Pertanto, il nostro metodo può essere utilizzato per rilevare in modo efficace e rapido metastasi peritoneali e per acquisire informazioni cellulari elettriche.
Le dimensioni e le caratteristiche elettriche tra le cellule tumorali gastriche e le cellule del lavaggio peritoneale erano significativamente diverse. Pertanto, il metodo OEK potrebbe teoricamente separare le cellule tumorali gastriche dall’ascite e dai lavaggi peritoneali.
Attraverso esperimenti, i ricercatori hanno separato le cellule tumorali gastriche dall’ascite di sei pazienti con purezza fino al 71%. Rispetto al tradizionale metodo clinico di rilevazione della metastasi peritoneale, questo nuovo metodo ha risolto il problema della bassa sensibilità.
È anche una tecnica senza etichette, non distruttiva e rapida. I ricercatori hanno potuto separare e raccogliere cellule di cancro gastrico nel chip microfluidico OEK in 5 minuti.
Hanno anche ottenuto le capacità della membrana cellulare delle cellule tumorali gastriche e delle cellule di lavaggio peritoneale. Questi dati digitali possono essere usati come bio-marker, come parte delle informazioni cellulari.
I risultati sperimentali nello studio hanno dimostrato che il metodo OEK proposto era in grado di rilevare cellule tumorali libere nell’ascite e di accelerare la diagnosi delle metastasi peritoneali nel carcinoma gastrico.
Fonte: Advances Science