La sindrome di Crigler-Najjar colpisce circa uno su un milione di persone alla nascita.
A causa di un gene difettoso, questi individui non possiedono un enzima essenziale nel loro fegato per eliminare la bilirubina, un pigmento di bile tossico che si accumula in tutti i tessuti corporei causando ittero e potenzialmente portando a danni neurologici irreversibili e letali.
I ricercatori del progetto CURECN finanziato dall’UE stanno studiando quel gene difettoso, noto come UGT1A1 e sviluppando e testando nuove tecniche di terapia genica per sostituirlo con sicurezza con una copia sana. L’obiettivo è ripristinare la normale funzionalità epatica e curare efficacemente la sindrome di Crigler-Najjar.
‘Sebbene estremamente raro, il carico sanitario, finanziario ed emotivo della sindrome CN è molto alto. La mancanza di una cura permanente per la malattia si traduce in un’aspettativa di vita ridotta e una qualità di vita ridotta per le persone affette da questa malattia genetica “, afferma Federico Mingozzi, coordinatore del progetto CURECN e responsabile del gruppo Immunologia e terapia genica del fegato all’Istituto di ricerca Genethon in Francia.
“Si prevede quindi che il progetto CURECN porti benefici significativi ai pazienti e riduca il carico socioeconomico della sindrome”, ha aggiunto il ricercatore.
Un’alternativa ai trapianti di fegato
L’approccio CURECN utilizza un innocuo virus adeno-associato (AAV) come vettore per fornire informazioni genetiche correttive nel corpo. I virus adeno-associati, che sono infettivi per gli esseri umani, ma non sono noti per avere effetti dannosi, sono attualmente i vettori scelti per molti trattamenti di terapia genica emergenti.
Sono stati precedentemente utilizzati in promettenti studi sull’uomo di terapie di trasferimento genico nel fegato per trattare l’emofilia e il trasferimento del gene nell’occhio per trattare la cecità congenita.
I partner di CURECN hanno progettato un vettore AAV ottimizzato per indirizzare in sicurezza le cellule del fegato con una copia sana del gene difettoso responsabile della CN. Avendo mostrato risultati promettenti in studi preclinici, il progetto ha ora avviato un trial umano che ha coinvolto 17 pazienti Crigler-Najjar in quattro centri medici in Europa.
“Il nostro obiettivo è dimostrare la sicurezza e l’efficacia della terapia negli studi clinici, aprendo la strada all’approvazione normativa e alla commercializzazione di una cura per i pazienti Crigler-Najjar, sperando che possano vivere una vita normale senza sintomi”, dice Fanny Collaud , vicedirettore del progetto.
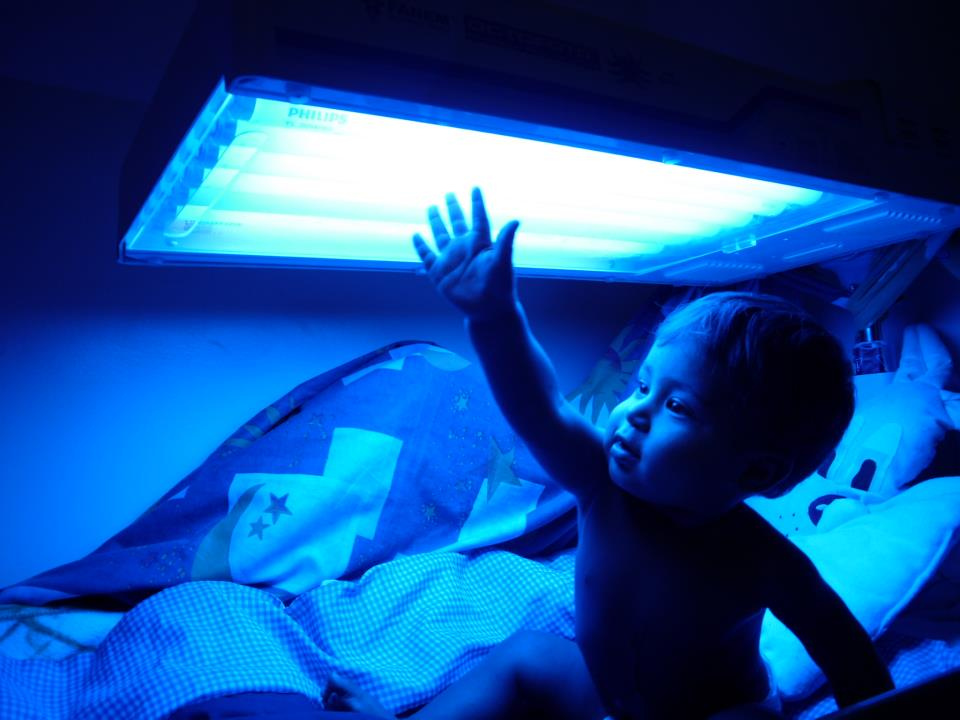
Al momento, l’unico modo per controllare i sintomi di Crigler-Najjar richiede ai pazienti di sottoporsi a sessioni di fototerapia prolungate in cui sono sottoposti a lunghezze d’onda speciali di luce blu per un massimo di 10 o 12 ore al giorno per ridurre i livelli di bilirubina. L’unica cura è un trapianto di fegato, una procedura costosa e rischiosa con effetti collaterali a lungo termine, che richiede ai pazienti di assumere farmaci immunosoppressivi per tutta la vita al fine di impedire al loro sistema immunitario di respingere il nuovo fegato.
Tecnologie all’avanguardia
La terapia genica affronta una sfida immunosoppressiva simile, anche se solo per un periodo limitato di tempo in prossimità della somministrazione del vettore, poiché i pazienti possono sviluppare risposte anticorpali sostenute ai vettori AAV. Il consorzio CURECN sta quindi sviluppando nuove tecnologie per sopprimere le risposte immunitarie e rimuovere gli anticorpi preesistenti.
Ciò consentirà di somministrare il trattamento a pazienti che hanno precedentemente sviluppato un’immunità all’AVA, o di ri-somministrare la terapia genica a pazienti precedentemente trattati se necessario per raggiungere l’efficacia a lungo termine.
“Le innovazioni derivate dagli studi CURECN avranno un impatto importante sullo sviluppo di tutte le terapie geniche basate su vettori AAV per le malattie ereditarie, in particolare per altre forme di malattie metaboliche del fegato“, afferma Collaud.
“La terapia di trasferimento genico del fegato ha il potenziale per ridurre il carico di ospedalizzazione e di cura per molte malattie, molte delle quali colpiscono i bambini; ridurre le complicazioni e la morbilità associate ai trattamenti attuali e potenzialmente fornire un’alternativa al trapianto di fegato”.
Fonte, European Commission