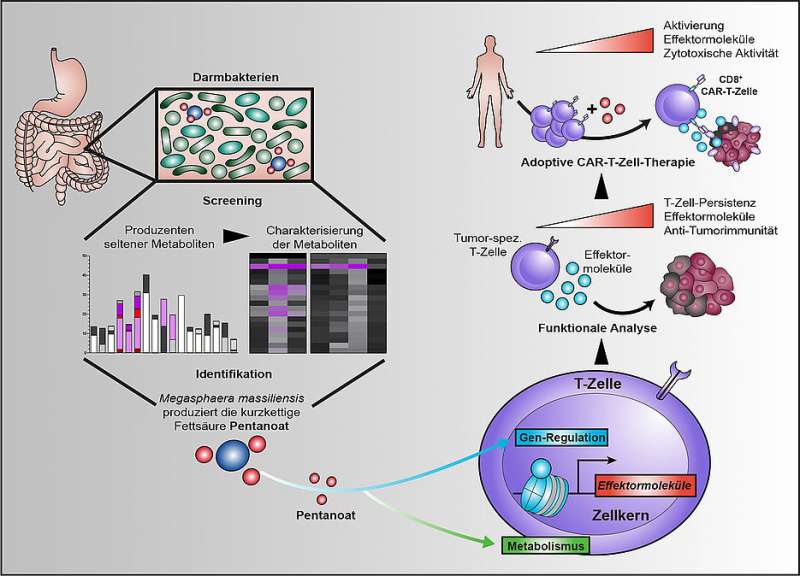
(Microbioma-Immagine: il batterio Megasphaera massiliensis produce l’acido grasso pentanoato a catena corta nel tratto digestivo umano. È in grado di alterare alcune -cellule del sistema immunitario in modo che possano combattere i tumori in modo più efficace. Questo vale anche per le cellule CAR-T. Attestazione: Maik Luu).
Il microbioma è la vasta collezione di batteri nell’intestino umano. Si stima che ogni persona porti circa 100 trilioni di cellule batteriche nel proprio tratto digestivo, appartenenti a diverse migliaia di specie. Si ritiene che questi batteri siano coinvolti nello sviluppo di malattie infiammatorie croniche intestinali, nell’innescare il diabete, nell’essere responsabili dell’obesità e anche nelle malattie neurologiche come la sclerosi multipla e il Parkinson, per non parlare di depressioni e disturbi autistici.
Il microbioma è stato al centro della ricerca per 20 anni, da quando una nuova tecnica ha permesso di analizzare questi batteri in modo rapido e preciso: il sequenziamento ad alto rendimento. Da allora, c’è stato un numero crescente di scoperte secondo cui il microbioma, a volte indicato anche come il secondo genoma umano, non è solo di importanza centrale per la digestione, ma influenza anche, se non controlla, almeno un gran numero di funzioni corporee. Il sistema immunitario in questo contesto è menzionato particolarmente frequentemente.
Spiegano gli autori:
“I dati emergenti dimostrano che l’attività delle cellule immunitarie può essere modulata da molecole microbiche. Qui, mostriamo che gli acidi grassi a catena corta (SCFA) pentanoato e butirrato migliorano l’attività antitumorale dei linfociti T citotossici (CTL) e delle cellule T del recettore dell’antigene chimerico (CAR) attraverso la riprogrammazione metabolica ed epigenetica. Mostriamo che il trattamento in vitro di CTL e cellule CAR T con pentanoato e butirrato aumenta la funzione di mTOR come sensore metabolico cellulare centrale e inibisce l’attività dell’istone deacetilasi di classe I. Questa riprogrammazione si traduce in un’elevata produzione di molecole effettrici come CD25, IFN-γ e TNF-α e migliora significativamente l’attività antitumorale dei CTL antigene-specifici e delle cellule CAR T che prendono di mira ROR1 nei modelli di melanoma murino singenico e di cancro del pancreas. I nostri dati fanno luce su molecole microbiche che possono essere utilizzate per migliorare l’immunità cellulare antitumorale. Collettivamente, identifichiamo pentanoato e butirrato come due SCFA con utilità terapeutica nel contesto dell’immunoterapia del cancro. È stato dimostrato che il microbiota intestinale ha un impatto diretto sull’efficacia di terapie immunitarie specifiche per il cancro. In particolare, la terapia inibitoria del checkpoint immunitario (ICI) e la terapia cellulare adottiva che utilizzano linfociti T citotossici CD8 + tumore-specifici (CTL) possono essere influenzate dalla composizione del microbiota intestinale. Recentemente, numerosi studi hanno dimostrato che i membri della flora intestinale sono in grado di migliorare l’efficacia antitumorale di PD-1 e CTLA4 blocco terapia. Akkermansia muciniphila e alcuni Bifidobacterium è stato dimostrato che sono i ceppi che modulano le risposte immunitarie antitumorali e migliorano il trattamento con ICI. Inoltre, un consorzio commensale definito composto da 11 ceppi batterici umani ha suscitato una forte immunità antitumorale mediata da cellule CD8 + T in un modello sperimentale di tumore sottocutaneo. Questo studio ha dimostrato che una miscela di commensali abbondante negli umani è in grado di migliorare notevolmente l’efficacia della terapia ICI nei topi”.
Il microbioma influenza il sistema immunitario
Scienziati delle Università di Würzburg e Marburg sono ora riusciti per la prima volta a dimostrare sperimentalmente che i metaboliti batterici sono in grado di aumentare l’attività citotossica di alcune cellule immunitarie e quindi influenzare positivamente l’efficacia delle terapie antitumorali. Idealmente, la composizione delle specie batteriche nel microbioma potrebbe essere utilizzata per controllarne l’influenza sul successo della terapia.
Il team di ricerca ha pubblicato i risultati del suo studio sulla rivista Nature Communications. Responsabile della scoperta è stato il Dottor Maik Luu, postdoc nel laboratorio del Professor Michael Hudecek presso la clinica medica e il policlinico II dell’Ospedale universitario di Würzburg. Un altro partecipante è stato il Professor Alexander Visekruna dell’Istituto di microbiologia medica e igiene dell’Università Philipps di Marburg, dove Luu ha svolto ricerche prima di trasferirsi a Würzburg.
Vedi anche:Come il microbioma potrebbe guidare i disturbi cerebrali
Gli acidi grassi aumentano l’attività delle cellule killer
“Siamo stati in grado di dimostrare che gli acidi grassi a catena corta butirrato e, in particolare, il pentanoato sono in grado di aumentare l’attività citotossica delle cellule T CD8″, dice Maik Luu che descrive il risultato centrale dello studio ora pubblicato. Le cellule T CD8 sono talvolta chiamate anche cellule killer. Come parte del sistema immunitario, è loro compito uccidere specificamente le cellule dannose per l’organismo.
Gli acidi grassi a catena corta, a loro volta, appartengono alla classe più dominante di metaboliti del microbioma intestinale. Da un lato, possono stimolare il metabolismo delle cellule T inducendo regolatori centrali del metabolismo energetico. Dall’altro possono inibire specifici enzimi che regolano l’accessibilità al materiale genetico e quindi l’espressione genica nelle cellule T. In tal modo, inducono cambiamenti epigenetici.
I modelli di tumore solido vengono combattuti in modo più efficace
“Quando gli acidi grassi a catena corta riprogrammano le cellule T CD8, uno dei risultati è un aumento della produzione di molecole pro-infiammatorie e citotossiche”, spiega Luu. Nell’esperimento, il trattamento con il pentanoato di acidi grassi ha aumentato la capacità delle cellule T tumore-specifiche di combattere i modelli di tumore solido. “Siamo stati in grado di osservare lo stesso effetto quando combattiamo le cellule tumorali con le cosiddette cellule CAR-T“, afferma lo scienziato.
Le cellule CAR-T sono indicate come “cellule T del recettore dell’antigene chimerico”. Mentre le cellule T normali sono in gran parte “cieche” nei confronti delle cellule tumorali, le cellule T CAR sono in grado di riconoscere specifici antigeni bersaglio sulla superficie del tumore e distruggere le cellule tumorali grazie a una modifica genetica. Michael Hudecek è uno dei massimi esperti nel campo della ricerca sulle cellule CAR-T.
Controllo mirato tramite la composizione del microbioma
“I risultati sono un esempio di come i metaboliti dei batteri intestinali possono modificare il metabolismo e la regolazione genica delle nostre cellule e quindi influenzare positivamente l’efficienza delle terapie antitumorali“, afferma Maik Luu. In particolare, l’uso delle cellule CAR-T contro i tumori solidi potrebbe trarne beneficio.
In questi casi, la terapia con cellule geneticamente modificate è stata finora molto meno efficace del trattamento di tumori ematologici come la leucemia. “Questo potrebbe cambiare se le cellule CAR-T fossero trattate con pentanoato o altri acidi grassi a catena corta prima di essere utilizzate nei pazienti”, sperano gli scienziati.
Questo effetto potrebbe essere sfruttato in modo specifico attraverso la composizione della colonizzazione intestinale batterica, soprattutto perché Luu e gli altri coinvolti nello studio sono stati anche in grado di identificare il produttore essenziale di pentanoato della flora intestinale: il batterio Megasphaera massiliensis.
Una lunga strada verso le applicazioni cliniche
Tuttavia, c’è ancora molta strada da fare prima che le nuove scoperte portino a nuove terapie per i malati di cancro. In una fase successiva, il team di ricerca amplierà inizialmente lo spettro delle malattie tumorali indagate e, oltre ad altri tumori solidi, esaminerà anche le malattie tumorali ematologiche come il mieloma multiplo. Inoltre, il team vuole studiare più intensamente il funzionamento degli acidi grassi a catena corta al fine di identificare i punti di partenza per modifiche genetiche mirate.
Fonte:Nature