(Melanoma-Immagine Credit Public Domain).
L’ipossia o l’inadeguata ossigenazione di un tessuto, è una condizione che si verifica frequentemente in tutti i tumori solidi come il melanoma, un cancro della pelle. Le cellule del melanoma non solo sono in grado di sopravvivere alla privazione di ossigeno, ma anche di usarla a proprio vantaggio dirottando la risposta immunitaria antitumorale e sviluppando meccanismi di resistenza alle terapie antitumorali convenzionali.
Un gene chiave responsabile dell’adattamento delle cellule cancerose all’ipossia è HIF-1α (Hypoxia Inducible Factor-1 alfa). Guidato dal Dottor Bassam Janji, capo del gruppo di ricerca sull’immunoterapia e il microambiente (TIME) presso l’Istituto di sanità del Lussemburgo (LIH) e in collaborazione con il Gustave Roussy Cancer Center in Francia e il Thumbay Research Institute of Precision Medicine presso la Gulf Medical University di negli Emirati Arabi Uniti, il team ha utilizzato tecnologie di editing genetico per mostrare come prendere di mira l’HIF-1α non solo potrebbe inibire la crescita del tumore, ma anche guidare le cellule immunitarie citotossiche (tossiche per le cellule) al tessuto canceroso.
Questa scoperta ha fornito un nuovo prezioso obiettivo per rendere i melanomi resistenti, più vulnerabili ai trattamenti antitumorali disponibili.
I risultati dello studio sono stati recentemente pubblicati in Oncogene Journal.
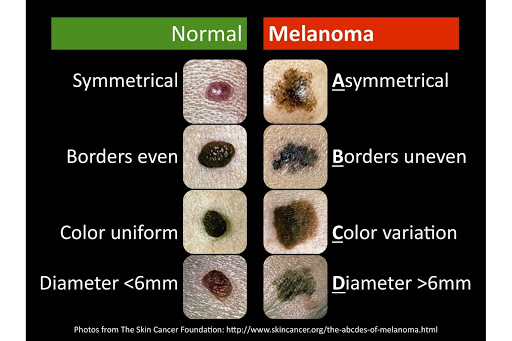
Il melanoma è un tipo di cancro della pelle che si sviluppa dai melanociti, cellule responsabili della produzione di pigmenti. I melanomi diventano più difficili da trattare se non vengono rilevati precocemente e la resistenza emergente al trattamento costituisce un’importante barriera alla loro gestione efficace. A causa del loro rapido tasso di crescita e del basso apporto di sangue, i tumori solidi, incluso il melanoma, presentano spesso aree di ipossia. L’ipossia, o la diminuzione dell’ossigeno nel microambiente tumorale, normalmente causerebbe la morte delle cellule tumorali. “Tuttavia, alcuni tumori solidi si sono evoluti per sopravvivere a questo microambiente ostile attivando HIF-1α, un gene che si dice sia un importante fattore che media la risposta adattativa ai cambiamenti nel livello di ossigeno dei tessuti”, dice il Dr Bassam Janji, capo del gruppo di ricerca sull’immunoterapia e il microambiente dei tumori (TIME), Istituto di Salute del Lussemburgo.
William G. Kaelin Jr, Sir Peter J. Ratcliffe e Gregg L. Semenza hanno ricevuto il Premio Nobel per la fisiologia o la medicina nel 2019 per la loro scoperta di HIF-1α e come le cellule lo usano per rilevare l’ipossia. È stato anche segnalato che l’ipossia è responsabile del fallimento della risposta del tumore alle terapie antitumorali convenzionali e può prevenire l’infiltrazione di cellule immunitarie nel tumore. È quindi fondamentale comprendere i meccanismi con cui le cellule tumorali superano questo ambiente ipossico per migliorare l’efficacia delle terapie antitumorali disponibili.
In questo contesto, il team guidato dal Dott. Janji ha cercato di inattivare la funzionalità del gene HIF-1α utilizzando la tecnologia di editing genico CRISPR e di studiare l’impatto di tale inattivazione sulla crescita del tumore, l’infiltrazione delle cellule immunitarie e la risposta all’immunoterapia in un modello murino di melanoma preclinico.
Vedi anche:Melanoma: individuato nuovo obiettivo farmacologico
“Il nostro studio ha rivelato che il blocco dell’attività di HIF-1α ha inibito significativamente la crescita del melanoma e amplificato l’infiltrazione delle cellule immunitarie nel microambiente tumorale aumentando il rilascio di CCL5, un mediatore ben definito coinvolto nella guida delle cellule immunitarie citotossiche sul campo di battaglia del tumore”, riassume la Dr.ssa Audrey Lequeux, prima autrice della pubblicazione. È importante sottolineare che lo studio ha anche dimostrato che la combinazione di un farmaco ideato per fermare l’ipossia migliora significativamente l’immunoterapia del melanoma. Quando i risultati sono stati convalidati retrospettivamente in una coorte di 473 pazienti con melanoma, la firma ipossica dei tumori è stata correlata a esiti peggiorati e alla mancanza di infiltrazione di cellule immunitarie nei tumori, che è considerata una delle principali caratteristiche della resistenza del tumore alle immunoterapie.
“Insieme, i nostri dati sostengono con forza che le strategie terapeutiche che interrompono l’HIF-1α sarebbero in grado di modulare il microambiente tumorale per consentire l’infiltrazione delle cellule immunitarie. Tali strategie potrebbero essere utilizzate per migliorare le immunoterapie antitumorali basate sul vaccino e sul blocco del checkpoint immunitario in non pazienti con melanoma responsivo“, concludono rispettivamente il Dr.Chouaib e il Dr.Janji della Gulf Medical University e del Luxembourg Institute of Health.
Lo studio è stato pubblicato a giugno sulla rivista Oncogene, parte del prestigioso gruppo editoriale Nature. L’articolo è stato inserito nella categoria ‘breve comunicazione’, una categoria riservata ad articoli di eccezionale interesse per il loro significato e contributo tempestivo alla biologia del cancro.