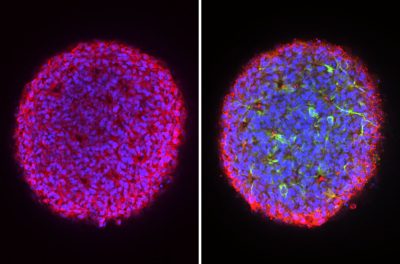
Malattie rare/ Art. di Jocelyn Kaiser, scrittrice della rivista Science. Immagine: minicuori noti come organoidi ricavati dalle cellule di un paziente con distrofia muscolare di Duchenne. L’organoide a destra è stato trattato con un farmaco RNA su misura che lo ha aiutato a produrre una proteina mancante, la distrofina (verde). John Means.
Il nuovo metodo riduce i tempi di test dei farmaci a base di RNA su misura da mesi a settimane.
Decine di migliaia di bambini nascono ogni anno con malattie misteriose causate da mutazioni genetiche così rare che nessuno ha ancora provato a sviluppare una cura. Ora, i ricercatori hanno trovato un modo per usare minuscole macchie di tessuto cresciute dalle cellule del sangue dei pazienti per accelerare il lavoro di laboratorio necessario per testare farmaci personalizzati per alcuni di questi bambini malati. Il loro studio, pubblicato oggi su Nature, suggerisce che questi “organoidi” cresciuti in laboratorio possono aiutare a prevedere gli effetti del trattamento dei farmaci genetici realizzati con RNA. “Non è mai stato fatto un test sui farmaci RNA personalizzati usando tessuti creati dalle cellule di un paziente”, afferma la biologa dello sviluppo Madeline Lancaster del Medical Research Council Laboratory of Molecular Biology, che non è stata coinvolta nel lavoro. “Questo è uno studio molto impressionante e importante”, afferma, “che potrebbe ridurre i costi elevati e accelerare il ritmo della medicina personalizzata”.
Il responsabile dello studio, il biologo molecolare Scott Younger del Children’s Mercy Research Institute, è stato ispirato dalla storia di Mila, una bambina con una rara malattia cerebrale chiamata malattia di Batten che è temporaneamente migliorata dopo che i ricercatori hanno rapidamente sviluppato un farmaco su misura per la sua insolita mutazione causa della malattia. Il farmaco era un oligonucleotide antisenso (ASO), un filamento di RNA in grado di correggere una mutazione colmando un difetto nell’RNA messaggero del gene, il modello per costruire una proteina. Younger voleva sviluppare ASO su misura per i pazienti arruolati in un’iniziativa presso il suo Istituto che mira a sequenziare i genomi di 30.000 bambini con rare condizioni genetiche in 7 anni, per identificare le mutazioni che causano la malattia.
I ricercatori spesso sviluppano farmaci ASO su misura testandoli sulle cellule cutanee coltivate del paziente. Younger voleva invece convertire le cellule del sangue in cellule staminali pluripotenti indotte (iPS), cellule immature che possono essere trasformate nei tipi di cellule specifici coinvolti nella malattia di una persona, come il cervello o i muscoli. Il suo laboratorio avrebbe esposto queste cellule a farmaci candidati, quindi avrebbe previsto quanto potrebbero essere efficaci in quel tessuto in base ai cambiamenti nell’espressione genica delle cellule o ad altri cambiamenti. “Ma pagare un laboratorio commerciale per generare cellule iPS dalle cellule di un paziente costa migliaia di dollari e può richiedere fino a un anno”, ha detto Younger.
Pensò che doveva esserci un modo migliore. Quindi, il suo laboratorio per prima cosa armeggiò con un cocktail di sostanze chimiche spesso usate per convertire le cellule del sangue in cellule iPS. I ricercatori escogitarono una formula diversa che accorciò questo processo di conversione da molti mesi a sole 2 o 3 settimane. Poi usarono altre sostanze chimiche per trasformare queste cellule in grumi di tessuto muscolare, cardiaco o cerebrale che potevano essere testati per cambiamenti di funzione che avrebbero potuto indicare se un trattamento avrebbe potuto funzionare.
Uno di questi trattamenti era un farmaco ASO approvato per la distrofia muscolare di Duchenne (DMD), in cui il corpo è privo di una proteina chiamata distrofina che è fondamentale per la funzione dei muscoli, incluso il cuore. “Quando i ricercatori hanno aggiunto questo farmaco agli organoidi cardiaci realizzati da un paziente con la mutazione a cui è destinato, hanno iniziato a produrre distrofina e sono passati dal “semplicemente seduti nella capsula” alla contrazione”, afferma Younger. Il suo gruppo ha quindi realizzato organoidi cardiaci personalizzati per due fratelli con DMD causata da una mutazione diversa er la quale manca un farmaco approvato. “L’aggiunta di un ASO personalizzato per la loro mutazione ha causato in modo simile la contrazione degli organoidi, suggerendo che anche questo potrebbe avere dei benefici“, riferisce il team.
Il laboratorio di Younger ha ormai creato cellule iPS per oltre 300 pazienti. Oltre a studiare ASO su misura, il team sta anche testando la capacità dei farmaci anticonvulsivanti approvati di calmare l’attività neuronale negli organoidi cerebrali realizzati dalle cellule di pazienti con varie forme di epilessia. “I risultati hanno persino portato alla decisione di somministrare un farmaco specifico a un paziente, il che ha ridotto le crisi del bambino”, afferma Younger. “Con questa nuova piattaforma di organoidi i nostri dottori saranno presto in grado di ordinare un test tramite noi, e noi lo faremo girare e daremo loro un risultato per guidare le decisioni terapeutiche”.
“In alcuni casi, gli organoidi potrebbero aver bisogno di più tempo per crescere prima di essere sottoposti a test”, avverte Francesco Saverio Tedesco, un clinico-scienziato che studia le malattie muscolari rare presso l’University College di Londra e il Francis Crick Institute. Questo perché per alcune malattie, il gene colpevole non viene espresso fino a quando un organo non matura. “Nonostante ciò”, afferma, “il documento sarà uno stimolo e un’ispirazione per molti ricercatori a lavorare sempre di più utilizzando sistemi di coltura 3D umanizzati per lo sviluppo di terapie nelle malattie rare”.
Leggi anche:Sindrome di Door: nuova terapia potrebbe curare malattie rare ed ereditarie
Al momento, i nuovi ASO che si dimostrano promettenti nei test sulle cellule derivate dai pazienti devono ancora superare costosi studi sugli animali per convincere gli enti regolatori che sono sicuri. Il neurologo Tim Yu del Boston Children’s Hospital, il cui team ha sviluppato l’ASO personalizzato per Mila, pensa che il potenziale più grande dei nuovi organoidi potrebbe essere quello di ridurre la necessità di tali studi di tossicologia sugli animali. “Questo è di gran lunga “il più grande ostacolo” al test di un ASO promettente su un paziente”, afferma.
Fonte:Science