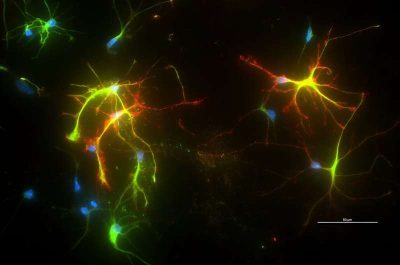
Malattie neurodegenrative-Questa immagine mostra l’effetto di polimeri simili a proteine (rossi) nelle cellule cerebrali di un modello murino. I polimeri su scala nanometrica sono progettati per alterare l’interazione tra due proteine per combattere lo stress ossidativo nelle cellule. Credito: Johnson Lab/UW-Madison.
Di Will Cushman, Università del Wisconsin-Madison.
Un nanomateriale di recente sviluppo che imita il comportamento delle proteine potrebbe essere uno strumento efficace per il trattamento dell’Alzheimer e di altre malattie neurodegenerative. Il nanomateriale altera l’interazione tra due proteine chiave nelle cellule cerebrali, con un effetto terapeutico potenzialmente potente.
Le scoperte innovative, recentemente pubblicate sulla rivista Advanced Materials, sono state rese possibili grazie a una collaborazione tra gli scienziati dell’Università del Wisconsin-Madison e gli ingegneri specializzati in nanomateriali della Northwestern University.
Il lavoro è incentrato sull’alterazione dell’interazione tra due proteine che si ritiene siano coinvolte nel preparare il terreno per malattie come l’Alzheimer, il Parkinson e la sclerosi laterale amiotrofica o SLA.
La prima proteina si chiama Nrf2, un tipo specifico di proteina chiamata fattore di trascrizione che attiva e disattiva i geni all’interno delle cellule.
Una delle funzioni importanti di Nrf2 è il suo effetto antiossidante. Sebbene diverse malattie neurodegenerative derivino da processi patologici separati, un punto in comune tra loro è l’effetto tossico dello stress ossidativo sui neuroni e su altre cellule nervose. Nrf2 combatte questo stress tossico nelle cellule cerebrali, aiutando a prevenire le malattie.
Jeffrey Johnson, Professore alla UW-Madison School of Pharmacy, studia da decenni Nrf2 come obiettivo promettente per il trattamento delle malattie neurodegenerative insieme a sua moglie Delinda Johnson, scienziata senior della scuola di farmacia. Nel 2022, i Johnson e un altro gruppo di collaboratori hanno scoperto che l’aumento dell’attività di Nrf2 in uno specifico tipo di cellula nel cervello, gli astrociti, ha contribuito a proteggere i neuroni nei modelli murini del morbo di Alzheimer, portando a una perdita di memoria significativamente inferiore.
Sebbene questa ricerca precedente suggerisse che l’aumento dell’attività di Nrf2 potrebbe costituire la base di un trattamento per l’Alzheimer, gli scienziati hanno trovato difficile colpire efficacemente la proteina all’interno del cervello.
“È difficile far arrivare i farmaci al cervello, ma è stato anche molto difficile trovare farmaci che attivino Nrf2 senza molti effetti fuori bersaglio“, afferma Jeffrey Johnson.

Il nuovo nanomateriale, conosciuto come polimero simile alle proteine o PLP, è sintetico e progettato per legarsi alle proteine come se fosse esso stesso una proteina. Questo imitatore su scala nanometrica è il prodotto di un team guidato da Nathan Gianneschi, Professore di chimica alla Northwestern e membro della facoltà dell’Istituto Internazionale di Nanotecnologia dell’Università.
Gianneschi ha progettato più PLP per prendere di mira varie proteine. Questo particolare PLP è strutturato per alterare l’interazione tra Nrf2 e un’altra proteina chiamata Keap1. L’interazione o percorso delle proteine è un obiettivo ben noto per il trattamento di molte condizioni perché Keap1 controlla essenzialmente quando Nrf2 risponde e combatte lo stress ossidativo. Legate insieme in condizioni non stressate, Keap1 rilascia Nrf2 per svolgere il suo lavoro antiossidante quando necessario.
Ben presto, i Johnson e Gianneschi iniziarono a discutere la possibilità che il laboratorio UW-Madison fornisse cellule cerebrali modello murino necessarie per testare il nanomateriale proteico di Gianneschi.
Jeffrey Johnson afferma di essere stato inizialmente un po’ scettico riguardo all’approccio PLP, data la sua scarsa familiarità con esso e la difficoltà generale di individuare con precisione le proteine nelle cellule cerebrali.
La ricerca risultante ha dimostrato che PLP di Gianneschi era molto efficace nel legarsi a Keap1, liberando Nrf2 affinché si accumulasse nei nuclei delle cellule, amplificando la sua funzione antiossidante. È importante sottolineare che lo ha fatto senza causare gli effetti indesiderati fuori bersaglio che hanno ostacolato altre strategie volte ad attivare meglio Nrf2.
Leggi anche:Fusione mitocondriale: il fallimento energetico dietro le malattie neurodegenerative
Mentre quel lavoro è stato svolto su cellule in coltura, i Johnson e Gianneschi stanno ora facendo un ulteriore passo avanti nei modelli murini di malattie neurodegenerative. È una linea di ricerca nella quale non si aspettavano di essere coinvolti, ma che ora sono entusiasti di perseguire.
Fonte:Advanced Materials