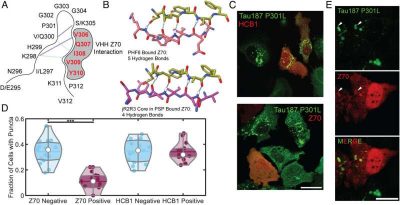
Malattie neurodegenerative-Immagine: studio dell’effetto del nanobody VHH Z70 sulla fibrillazione tau indotta da jR2R3 P301L nelle cellule. Credito: Atti dell’Accademia nazionale delle scienze (2024).
Uno spettro di malattie neurodegenerative, tra cui la demenza frontotemporale (FTD), la paralisi sopranucleare progressiva (PSP) e la degenerazione corticobasale (CBD), sono dovute all’accumulo di proteine tau anormali mal ripiegate nel cervello. Un team di ricercatori guidati dagli scienziati dell’UC Santa Barbara ha trovato potenziali modi per interrompere questo processo prendendo di mira i siti “appiccicosi” lungo la forma della tau mutata, prevenendo il ripiegamento errato e la diffusione dei grovigli neurofibrillari.
“Si tratta di una vera collaborazione tra biologia e chimica”, ha affermato il neuroscienziato dell’UCSB Kenneth S. Kosik che con i Professori di chimica Songi Han, Joan-Emma Shea e il Professore di ingegneria chimica Scott Shell, ha presentato i risultati negli Atti della National Academy of Sciences.
Lo studio presenta approfondimenti a livello molecolare sul modo in cui si diffonde la tau patologica e, secondo i ricercatori, questa comprensione potrebbe portare a “un intervento terapeutico potenzialmente in grado di disaggregare la tau o prevenirne l’aggregazione” nella forma lunga di accumulo di tau.
Una forcina appiccicosa
La Tau è una proteina strutturale essenziale nel cervello, che conferisce forma e stabilità alle cellule e consente il trasporto dei nutrienti necessari. Tuttavia, quando muta e si piega male, può diventare appiccicosa e aggrovigliata. Inoltre, questo errore nel ripiegamento può diventare un modello per istruzioni errate che indirizzano le normali proteine tau a ripiegarsi e accumularsi fino a quando la condizione si diffonde in ampie regioni del cervello, interferendo con le funzioni cerebrali. Le posizioni specifiche in cui si verificano questi grovigli neurofibrillari nel cervello differiscono tra le malattie neurodegenerative.
Esistono due forme particolari di tau, che costituiscono il punto di partenza di questa categoria di malattie neurodegenerative, chiamate tauopatie e di cui la più conosciuta è l’Alzheimer. Tau è prodotta sia in una versione breve “a tre ripetizioni” che in una versione più lunga “a quattro ripetizioni“; quest’ultima è il focus di questa ricerca.
Tauopatie molto meno comuni dell’Alzheimer come FTD, PSP e CBD sono esclusivamente taupatie del tipo 4R, sebbene le malattie neurodegenerative possano anche essere associate alla forma 3R o, come nel caso dell’Alzheimer, a una combinazione di entrambe. Le scoperte di questa ricerca riguardano le malattie che accumulano 4R tau.
Unendo tecniche avanzate come la microscopia elettronica a trasmissione e le simulazioni di dinamica molecolare con esperimenti in vitro che coinvolgono colture cellulari, il gruppo di ricerca è stato in grado di farsi un’idea delle condizioni in cui la proteina tau 4R patologica inizia a ripiegarsi male, a modellare altre proteine tau e ad aggregarsi.
“La tau si ripiega in un modo unico in ciascuna di queste malattie“, ha spiegato Kosik. “Una parte di essa si piega in una struttura a forcina solo nel 4R tau. All’interno della forcina“, ha spiegato, “c’è un segmento appiccicoso chiamato PHF6 che può legare e impilare altre proteine tau in grandi aggregazioni”.
Ma cosa accadrebbe se fosse possibile indurre l’aggregazione tau nella coltura cellulare e utilizzare il sistema per interferire con questo sito appiccicoso? “La creazione delle condizioni per la propagazione del tau funge da sistema ad alto rendimento per la scoperta di composti che potrebbero interferire con l’aggregazione del tau“, ha commentato Kosik.
I ricercatori hanno scoperto, ad esempio, che una singola sostituzione di amminoacidi lungo la proteina adiacente alla regione appiccicosa era sufficiente per prevenire l’aggregazione di tau indebolendo l’accesso alla porzione vulnerabile del peptide.
In altre indagini, i ricercatori hanno anche scoperto che i nanocorpi – frammenti di anticorpi – sintetizzati dal sangue dei camelidi (cammelli, lama e altri membri della famiglia dei Camelidi) erano in grado di legarsi alla regione PHF6, inibendo l’aggregazione del tau. Qualunque sia la terapia, la regione che comprende il segmento a forcina di 4R tau è la zona attiva apparentemente da colpire.
I ricercatori hanno ancora molta strada prima che possano essere sviluppate e approvate terapie mirate per inibire la formazione dei grovigli neurofibrillari che caratterizzano le tauopatie. Ma i risultati di questo articolo svelano interessanti percorsi potenziali per arrestare i passaggi critici verso l’accumulo di tau mutante.
“Vorremmo continuare a testare questa tecnologia su modelli animali”, ha detto Kosik, attribuendo credito al ricercatore post-dottorato e autore principale Andrew Longhini per i suoi “enormi contributi” alle idee e agli esperimenti riportati. Dal punto di vista chimico, anche il lavoro dei ricercatori laureati Austin DeBose e Samuel Lobo nell’ingegnerizzazione delle interazioni proteiche e nell’esecuzione del pesante lavoro computazionale è stato essenziale per il progetto”, ha affermato.
Leggi anche:Malattie neurodegenerative: trattamenti che contrastano i sintomi neuropsichiatrici
“È così interdisciplinare, è sorprendente“, ha detto Kosik. “Ho imparato così tanto da questo progetto. Oltre a far avanzare la ricerca su alcune forme di malattie neurodegenerative, questi risultati possono servire da punto di partenza per potenziali indizi verso terapie per la malattia di 3R Pick e per il più complesso morbo di Alzheimer“.