Malattie degenerative-Immagine: questa è una storia sulle proteine, su come funzionano male e su cosa fanno le cellule per prevenire il malfiunzionamento. Credito: Matt Perko, UC Santa Barbara.
Le proteine sono i cavalli da lavoro della vita. Gli organismi li usano come elementi costitutivi, recettori, processori, corrieri e catalizzatori. La struttura di una proteina è fondamentale per la sua funzione. Le proteine malformate non solo non riescono a svolgere i loro compiti, ma possono accumularsi e alla fine compromettere il funzionamento interno delle cellule. Di conseguenza, le proteine mal ripiegate causano una varietà di malattie degenerative, dall’Alzheimer e dal Parkinson alla retinite pigmentosa. Questi disturbi sono attualmente incurabili.
Un articolo dell’UC Santa Barbara rivela una nuova connessione tra una particolare proteina di trasporto degli ioni e lo smaltimento dei rifiuti della cellula, che tritura le proteine mal ripiegate per evitare il loro accumulo tossico. I risultati, pubblicati su Developmental Cell, identificano un obiettivo per il trattamento di queste condizioni debilitanti.
“Studiando la biologia cellulare di base nelle ovaie del moscerino della frutta, ci siamo imbattuti in un modo per prevenire la neurodegenerazione e riteniamo che questo abbia potenziali applicazioni nel trattamento di alcune malattie umane“, ha affermato l’autrice senior Denise Montell, Professoressa Duggan e Distinguished Professor presso il Dipartimento di Biologia Molecolare, Cellulare e dello Sviluppo.
Per 35 anni, il laboratorio di Montell ha studiato il movimento delle cellule nelle ovaie dei moscerini della frutta. “Potrebbe sembrare esoterico”, ammette lei per prima, “ma fornisce un modello fantastico per la mobilità cellulare. E il movimento cellulare è alla base dello sviluppo embrionale, guida la guarigione delle ferite e contribuisce alla metastasi del tumore“, ha spiegato. “Quindi è un comportamento cellulare davvero fondamentale che ci interessa comprendere a fondo“.
L’ambientazione e i personaggi
La stella di questo articolo è un gene chiamato ZIP7, che codifica per una proteina con lo stesso nome. Nel lavoro precedente, il team di Montell si è imbattuto in una mutazione in questo gene che comprometteva la mobilità cellulare, suscitando interesse.
La proteina ZIP7 trasporta gli ioni zinco all’interno di una cellula. Questi ioni sono estremamente rari all’interno del citoplasma, ma abbondanti nelle proteine dove spesso fanno parte dell’architettura e catalizzano le reazioni chimiche. “ZIP7 è conservato nell’evoluzione dalle piante ai lieviti, alle mosche fino agli esseri umani”, ha detto Montell. “Quindi sta facendo qualcosa di veramente fondamentale, perché è in circolazione da molto tempo“.
ZIP7 è anche l’unico trasportatore dello zinco presente nel reticolo endoplasmatico, una struttura membranosa in cui una cellula produce proteine destinate alla membrana esterna della cellula o alla secrezione fuori dalla cellula. Circa un terzo delle nostre proteine vengono prodotte qui.
Se ZIP7 è il nostro protagonista, allora le proteine mal ripiegate e il loro smaltimento sono il tema dello studio. Per le proteine, la funzione segue la forma. Non basta avere gli ingredienti giusti, una proteina deve ripiegarsi correttamente per funzionare correttamente. Le proteine mal ripiegate sono responsabili di una serie di malattie e disturbi.
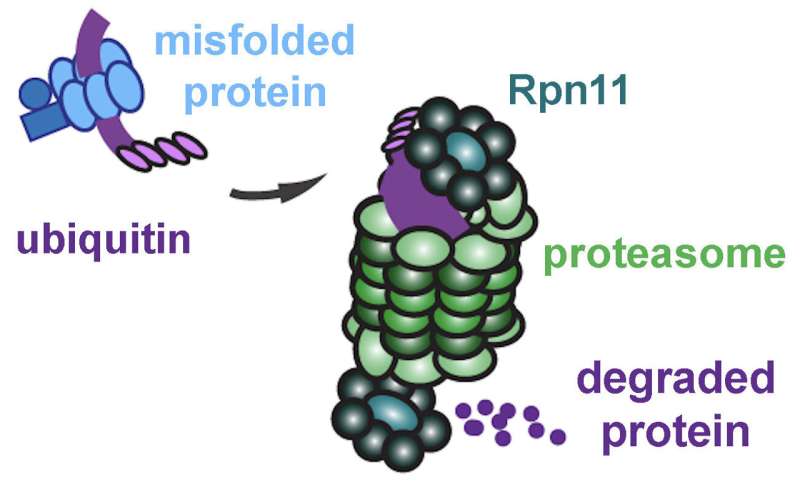
Ma le proteine a volte si ripiegano male anche in una cellula sana. Fortunatamente, le cellule dispongono di un sistema di controllo qualità per far fronte a questa eventualità. Se l’errore è piccolo, la cellula può provare a piegarla nuovamente. Altrimenti, contrassegnerà la molecola mal ripiegata con una piccola proteina chiamata ubiquitina e la invierà fuori dal reticolo endoplasmatico (ER) per il riciclaggio.
Nel citoplasma ci sono strutture chiamate proteasomi, i “tritarifiuti” della cellula. “Letteralmente masticano le proteine in piccoli pezzi che possono poi essere riciclati”, ha detto Montell.
“Ma se lo smaltimento dei rifiuti viene sopraffatto, allora la cellula subisce uno stress ER”. Ciò innesca una risposta che rallenta la sintesi proteica, mette in pausa la preparazione, e produce più proteasomi in modo che il sistema possa eliminare l’arretrato di rifiuti. Se tutto ciò fallisce, la cellula subisce la morte programmata.
La trama si infittisce
Il co-autore principale Xiaoran Guo, ex dottorato di ricerca di Montell, ha scoperto che la perdita di ZIP7 causava stress al RE nell’ovaio del moscerino della frutta. Quindi ha deciso di determinare se questo stress fosse la ragione per cui le cellule hanno perso la mobilità. In effetti, l’induzione dello stress ER con una diversa proteina mal ripiegata ha anche compromesso la migrazione cellulare.
Quando Guo ha sovraespresso ZIP7 in queste cellule, l’arretrato di proteine mal ripiegate è scomparso, lo stress ER è svanito e le cellule hanno riacquistato la loro mobilità. “Ero così sorpreso che ho dovuto chiedermi se avevo fatto tutto correttamente”, ha detto Guo. “Se questo fosse reale, ZIP7 da solo dovrebbe essere molto potente nel risolvere lo stress ER“.
Inoltre, la proteina mal ripiegata utilizzata, chiamata rodopsina, non contiene zinco nella sua struttura. Ciò ha portato Guo a sospettare che ZIP7 dovesse essere coinvolto da qualche parte nel percorso di degradazione. Il co-autore principale e collega dottorando Morgan Mutch, ha utilizzato un farmaco per impedire al proteasoma di degradare la rodopsina mal ripiegata e ha osservato che ciò annullava l’effetto benefico di ZIP7. Ha concluso che ZIP7 deve agire da qualche parte prima che il proteasoma divori la proteina mal ripiegata.
Gli autori hanno creato quattro geni ZIP7 modificati. Due mutazioni hanno interrotto la capacità della proteina di trasportare lo zinco, mentre le altre due l’hanno lasciata invariata. Hanno scoperto che il trasporto dello zinco era fondamentale nel ridurre lo stress del reticolo endoplasmatico.
A questo punto entra nella nostra storia un nuovo personaggio: l’enzima Rpn11, che fa parte del proteasoma. Le proteine mal ripiegate con tag ubiquitina non si adattano al proteasoma. Rpn11 taglia questi tag, consentendo alla proteina mal ripiegata di scivolare nel nucleo del proteasoma per il disassemblaggio. Lo zinco è essenziale per la Rpn11 per catalizzare la rimozione dell’ubiquitina.
“Sono rimasto molto sorpreso e poi emozionato, quando ho visto che l’aumento dell’espressione di ZIP7 preveniva quasi completamente l’accumulo di quelle proteine marcate con l’ubiquitina”, ha detto Mutch. “Ci aspettavamo il risultato opposto”.
Mutch ha stabilito che ZIP7 è fondamentale nel fornire zinco a Rpn11, consentendogli di tagliare i tag che etichettano le proteine difettose in modo che si adattino alla struttura che le scompone effettivamente. Il blocco dell’enzima Rpn11 ha confermato questa ipotesi.
“Quella sensazione quando scopri qualcosa di nuovo, qualcosa che nessuno ha mai capito prima, è la sensazione migliore per uno scienziato“, ha aggiunto Mutch.
Una potenziale terapia
I risultati suggeriscono che la sovraespressione di ZIP7 potrebbe costituire la base per il trattamento di una varietà di malattie. Ad esempio, la rodopsina mal ripiegata causa la retinite pigmentosa, una malattia congenita che porta alla cecità attualmente incurabile. Gli scienziati hanno già un ceppo di moscerini della frutta con la mutazione che causa una malattia simile, quindi il team ha sovraespresso il gene ZIP7 in questi moscerini per vedere cosa sarebbe successo.
“Abbiamo scoperto che la sovraespressione di ZIP7 previene la degenerazione della retina e la cecità”, ha detto Montell. Ciascuno dei moscerini con rodopsina mutante di solito sviluppa retinite pigmentosa, ma un buon 65% di quelli con ZIP7 iperattivo formava occhi che rispondono normalmente alla luce.
Il laboratorio di Montell sta ora collaborando con il Professor Dennis Clegg, sempre presso l’UC Santa Barbara, per studiare ulteriormente l’effetto di ZIP7 negli organoidi retinici umani, colture di tessuti che portano una mutazione che causa la retinite pigmentosa. Montell, Clegg e i loro colleghi intendono verificare l’ipotesi che la terapia genica ZIP7 prevenga la cecità nei pazienti con retinite pigmentosa.
Inoltre, la capacità del proteasoma diminuisce con l’avanzare dell’età, contribuendo a molti classici segni dell’invecchiamento e aumentando la probabilità di malattie degenerative legate all’età. Le terapie mirate a ZIP7 potrebbero potenzialmente rallentare anche lo sviluppo o la progressione di questi disturbi. Hanno già prodotto risultati promettenti che prolungano la durata della vita dei moscerini della frutta.
Leggi anche:Malattie degenerative dell età, nuova speranza
“Questo è stata guidata dalla curiosità“, ha detto Montell. “Stai semplicemente studiando qualcosa perché è interessante, segui i dati e finisci per scoprire qualcosa che non avevi mai pensato di studiare, forse anche una cura per molteplici malattie“.
Fonte:Developmental Cell

