di parti delle cellule dei pazienti?
Una proteina chiamata STING è uno dei principali fattori scatenanti dell’infiammazione nell’organismo e, quando non funziona correttamente, ad esempio a causa di una mutazione genetica, può causare condizioni che provocano gravi infiammazioni.
Una di queste condizioni autoimmuni è la vasculopatia ultra rara associata a STING con esordio nell’infanzia (SAVI). Inizia nell’infanzia a causa di proteine STING mutate e causa un’infiammazione debilitante nella pelle, nei polmoni e in altri organi vitali. Dal 1980, a più di 50 persone è stata diagnosticata la SAVI e ci sono poche opzioni di trattamento per questa patologia. Molti pazienti muoiono entro i primi 20 anni di vita.
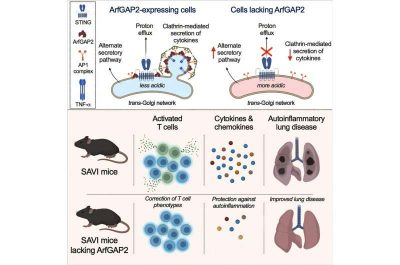
Un’altra delle funzioni principali di STING è la regolazione dell’acidità all’interno dell’apparato di Golgi, una struttura all’interno delle cellule che elabora, confeziona e trasporta proteine e lipidi nel corpo. Un tipo di proteina che l’apparato di Golgi trasporta è la citochina, che è importante per la crescita e l’attività del sistema immunitario. Le fluttuazioni nel livello di acidità dell’apparato di Golgi possono influenzare quel sistema di trasporto, a sua volta influenzando le citochine e quindi il sistema immunitario.
Una “proteina helper” è fondamentale
“Sapevamo già che STING regolava l’acidità dell’apparato di Golgi. Ciò avviene tramite l’attività del canale protonico, un sistema tramite il quale gli atomi di idrogeno possono muoversi attraverso le membrane cellulari. Ma il modo esatto in cui STING controllava l’acidità non era del tutto chiaro”, ha affermato l’autore senior Jonathan Miner, MD, Ph.D., professore associato di reumatologia e microbiologia e membro del Colton Center for Autoimmunity della Penn. “Quando abbiamo esaminato l’intero genoma di un paziente con SAVI, siamo stati condotti a una proteina che influenzava direttamente STING chiamata ArfGAP2“.
Insieme al coautore senior David Kast, Ph.D., ex ricercatore post-dottorato presso la Penn Medicine e ora professore associato di biologia cellulare e fisiologia presso la Washington University di St. Louis, Miner e il team hanno scoperto che una proteina “helper”, ArfGAP2, si è rivelata cruciale in quanto influenza la capacità di STING e dell’attività del suo canale protonico di regolare l’acidità nell’apparato del Golgi.
Con il ruolo di ArfGAP2 identificato, i ricercatori hanno esplorato il suo potenziale terapeutico tramite i loro piccoli modelli animali di SAVI. Quando hanno eliminato geneticamente ArfGAP2, si è verificato un calo significativo nell’attività STING che ha corrisposto a forti riduzioni nell’infiammazione e nell’attività autoimmune.
“È straordinario che qualcosa di così piccolo come l’acidità di un minuscolo organello all’interno di una cellula possa fare una differenza così grande“, ha affermato Miner.
Leggi anche:Malattie autoimmuni e allergie: una proteina potrebbe fermarle
Potenziale terapeutico per centinaia di malattie autoimmuni
Oltre a SAVI, STING è coinvolta in centinaia di malattie, tra cui alcune forme di lupus e la vasculopatia retinica con leucoencefalopatia cerebrale (RVCL), una delle principali aree di interesse di Miner nella ricerca e nella pratica clinica.
“La nostra ricerca non solo chiarisce le basi genetiche dell’autoimmunità, ma apre anche nuove strade a trattamenti trasformativi volti a migliorare la vita di milioni di persone“, ha affermato Miner.
In futuro, i ricercatori sperano di sviluppare terapie che potrebbero essere istituite clinicamente per interrompere ArfGAP2, ad esempio attraverso medicinali a piccole molecole che potrebbero essere assunti semplicemente ingoiando una pillola.
Fonte: Cell