(Malattia renale cronica-Immagine Credit Public Domain).
Oggi, la Food and Drug Administration statunitense ha approvato le compresse orali di Farxiga (dapagliflozin) per ridurre il rischio di declino della funzionalità renale, insufficienza renale, morte cardiovascolare e ospedalizzazione per insufficienza cardiaca negli adulti con malattia renale cronica che sono a rischio di progressione della malattia. “La malattia renale cronica è un importante problema di salute pubblica e vi è un significativo bisogno insoddisfatto di terapie che rallentano la progressione della malattia e migliorano i risultati. L’approvazione odierna di Farxiga per il trattamento della malattia renale cronica è un importante passo avanti per aiutare le persone che vivono con malattie renali”, dice Aliza Thompson, MD, MS, viceDirettore, divisione di cardiologia e nefrologia, Centro per la valutazione e la ricerca sui farmaci della FDA.
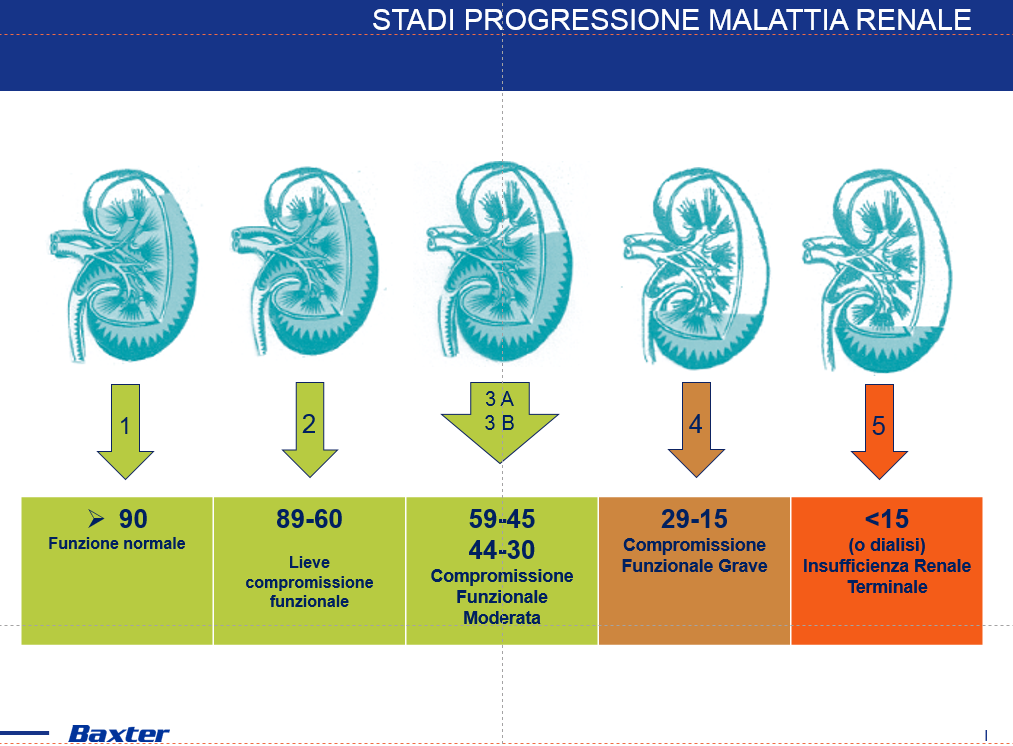
La malattia renale cronica si verifica quando i reni sono danneggiati e non possono filtrare il sangue normalmente. A causa di questo filtraggio difettoso, i pazienti possono avere complicazioni legate a fluidi, elettroliti (minerali necessari per molti processi corporei) e accumulo di rifiuti nel corpo. La malattia renale cronica a volte può progredire in insufficienza renale. I pazienti sono anche ad alto rischio di malattie cardiovascolari, comprese malattie cardiache e ictus.
L’efficacia di Farxiga nel migliorare gli esiti renali e ridurre la morte cardiovascolare in pazienti con malattia renale cronica è stata valutata in uno studio multicentrico in doppio cieco. In questo studio, 4.304 pazienti sono stati assegnati in modo casuale a ricevere Farxiga o un placebo. Lo studio ha confrontato i due gruppi per il numero di pazienti la cui malattia è progredita fino a un endpoint composito (o combinato) che includeva almeno una riduzione del 50% della funzione renale, la progressione verso l’insufficienza renale o la morte cardiovascolare o renale. I risultati hanno mostrato che 197 dei 2.152 pazienti che hanno ricevuto Farxiga hanno avuto almeno uno degli eventi dell’endpoint composito rispetto a 312 dei 2.152 pazienti che hanno ricevuto un placebo. Lo studio ha anche confrontato i due gruppi per il numero di pazienti ricoverati in Ospedale per insufficienza cardiaca o morti per malattie cardiovascolari.
Farxiga non è stato studiato, né si prevede che sia efficace, nel trattamento della malattia renale cronica tra i pazienti con malattia renale policistica autosomica dominante o recessiva (caratterizzata da cisti multiple) o tra i pazienti che richiedono o hanno recentemente utilizzato una terapia immunosoppressiva per trattare la malattia renale.
Vedi anche:Agente antiossidante può prevenire la malattia renale cronica e il morbo di Parkinson
I pazienti non devono usare Farxiga se hanno una storia di gravi reazioni di ipersensibilità al farmaco o se sono in trattamento di dialisi. Casi gravi e pericolosi per la vita di cancrena di Fournier si sono verificati in pazienti con diabete che assumevano Farxiga. I pazienti devono prendere in considerazione una dose più bassa di insulina per ridurre il rischio di ipoglicemia (basso livello di zucchero nel sangue) se stanno assumendo anche Farxiga. Farxiga può causare disidratazione, gravi infezioni del tratto urinario, infezioni da lieviti ai genitali e acidosi metabolica o chetoacidosi (accumulo di acido nel sangue). I pazienti devono essere valutati per il loro stato di volume e la funzione renale prima di iniziare ad assumere Farxiga.
Farxiga è stato originariamente approvato nel 2014 per migliorare il controllo glicemico negli adulti con diabete di tipo 2 oltre alla dieta e all’esercizio fisico.
Farxiga ha ricevuto le designazioni Fast Track, Breakthrough Therapy e Priority Review per l’indicazione approvata oggi. Fast track è progettato per facilitare lo sviluppo e accelerare la revisione dei farmaci per trattare condizioni gravi e soddisfare un’esigenza medica non soddisfatta. La designazione della terapia innovativa è progettata per accelerare lo sviluppo e la revisione di farmaci destinati a trattare una condizione grave e l’evidenza clinica preliminare indica che il farmaco può dimostrare un miglioramento sostanziale rispetto alla terapia disponibile su uno o più endpoint clinicamente significativi. La revisione prioritaria indirizza l’attenzione generale e le risorse alla valutazione delle domande di farmaci che, se approvate, rappresenterebbero miglioramenti significativi nella sicurezza o nell’efficacia del trattamento, della diagnosi o della prevenzione di condizioni gravi rispetto alle applicazioni standard.
La FDA ha concesso l’approvazione di Farxiga ad AstraZeneca.