La malattia infiammatoria intestinale è accompagnata da una serie di cambiamenti nell’intestino, come un cambiamento nella permeabilità epiteliale, un cambiamento nella composizione dei microrganismi e livelli alterati di sostanze antimicrobiche secrete dalle cellule che rivestono l’intestino.
Scoprire se i cambiamenti sono una causa o un effetto dell’infiammazione è difficile. Sahar El Aidy, microbiologo dell’Università di Groningen (Paesi Bassi), insieme ai colleghi di San Diego (Stati Uniti), hanno ora svelato la catena causale che porta all’infiammazione.
I loro risultati sono stati pubblicati sulla rivista Gut Microbes il 29 maggio.
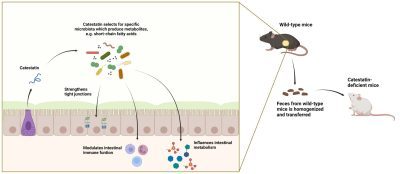
Gli scienziati hanno utilizzato topi in cui il gene responsabile della produzione del composto antimicrobico catestatina è stato eliminato con tecniche genetiche. Nei topi normali, la catestatina è secreta dalle cellule che rivestono l’intestino e uccide i ceppi batterici sensibili. Lo stesso team, guidato da Sahar El Aidy, Professore associato di microbiologia all’Università di Groningen, ha recentemente descritto come la composizione dei microbi intestinali fosse cambiata in questi topi knock-out e come fossero visibili segni di infiammazione dell’intestino.
Metaboliti
Nei loro esperimenti di follow-up, gli scienziati hanno utilizzato i trapianti fecali per scoprire se il cambiamento nella composizione microbica è effettivamente la causa dell’infiammazione o se è il risultato dell’infiammazione osservata. Sia i topi knock-out che i topi normali (wild-type) hanno ricevuto un lassativo che rimuoveva la maggior parte dei batteri dal loro intestino. “Abbiamo usato un lassativo, piuttosto che antibiotici, perché questi farmaci potrebbero ostacolare la ricolonizzazione dopo il trapianto fecale“, spiega El Aidy.
Ai topi knock-out sono state somministrate feci di topi wild-type e viceversa. Dopo due settimane, sono stati prelevati campioni per valutare la composizione microbica nell’intestino. “I risultati hanno mostrato che la composizione si era spostata verso quella del donatore, il che significa che i trapianti fecali hanno avuto successo”. L’analisi dei metaboliti all’interno dell’intestino ha mostrato che la produzione di acidi grassi a catena corta, molecole che influenzano la funzione dell’intestino, era ridotta nei topi knock-out. “Questa produzione è stata in gran parte ripristinata dal trapianto fecale di topi selvatici“, afferma El Aidy.
Vedi anche:IBD: svolta da terapia cellulare
Fibrosi
La riduzione della produzione di acidi grassi a catena corta è stata il risultato di un cambiamento nella comunità microbica nell’intestino, a sua volta causato dall’assenza di catastatina. “I nostri esperimenti hanno mostrato che la permeabilità epiteliale dell’intestino, che è maggiore nei topi knock-out, viene ripristinata dal trapianto fecale. Inoltre, l’entità della fibrosi derivante dall’infiammazione è stata ridotta“. Questi risultati mostrano che i cambiamenti nella composizione microbica causati dall’assenza di catestatina sono responsabili della risposta infiammatoria nei topi knock-out.
Obbiettivo
“Questo è un passo importante verso un trattamento per la malattia infiammatoria intestinale”, spiega El Aidy: “Utilizzando l’analisi del trascrittoma, abbiamo individuato un modello di espressione genica associato ai cambiamenti causati dalla rimozione della catestatina e che era simile a quello visto nella malattia infiammatoria intestinale. Potremmo collegare questo modello di espressione a un certo numero di specie microbiche, che sono, quindi, candidate per essere responsabili dei cambiamenti”.
Tuttavia, il piano dei ricercatori non è quello di trattare i pazienti con trapianti fecali. “Questo processo ha mostrato risultati contraddittori negli esseri umani”, dice. “Ciò potrebbe essere dovuto al fatto che non sapevamo cosa costituisce una sana composizione microbica negli esseri umani”. Invece, i risultati del nuovo studio hanno fornito strumenti per colpire ceppi batterici specifici che sono interessati dalla rimozione della catastatina. “Questo è ciò che mancava nei precedenti tentativi di ripristinare una sana comunità microbica intestinale“, conclude il ricercatore.
Fonte:Gut Microbes