Gli scienziati della Johns Hopkins University affermano di aver trovato nuove prove nelle cellule del cervello di topo cresciute in laboratorio, chiamate astrociti, che alla base della malattia di Alzheimer può esserci un semplice squilibrio nella chimica acido-alcalina o pH all’interno degli endosomi.
Gli astrociti lavorano per cancellare le cosiddette proteine beta amiloide dagli spazi tra i neuroni, ma decenni di prove hanno dimostrato che se il processo di chiarificazione va storto, le proteine amiloidi si accumulano intorno ai neuroni, portando alle caratteristiche placche amiloidi e alla degenerazione delle cellule nervose che sono le segni distintivi del morbo di Alzheimer che distrugge la memoria.
Il nuovo studio, descritto online il 26 giugno in Proceedings of the National Academy of Sciences, riporta inoltre che gli scienziati hanno somministrato farmaci chiamati inibitori dell’istone deacetilasi (HDAC) a cellule di topo progettate con una variante genetica del morbo di Alzheimer. L’esperimento ha invertito con successo il problema del pH e ha migliorato la capacità di clearance delle beta amiloidi.
( Vedi anche:Farmaco per l’ Alzheimer può arrestare la malattia se usato prima che si sviluppino i sintomi).
Gli inibitori dell’HDAC sono approvati dalla Food and Drug Administration statunitense per l’uso in persone con determinati tipi di tumori del sangue, ma non nelle persone con Alzheimer. I ricercatori sanno che la maggior parte degli inibitori dell’HDAC non possono attraversare la barriera emato-encefalica, una sfida significativa all’uso diretto dei farmaci per i disturbi cerebrali. Gli scienziati stanno pianificando ulteriori esperimenti per vedere se gli inibitori di HDAC hanno un effetto simile negli astrociti cresciuti in laboratorio dai pazienti con Alzheimer e se esiste il potenziale per progettare inibitori di HDAC in grado di attraversare la barriera ematoencefalica.
Tuttavia, sono necessarie molte più ricerche per verificare e spiegare la relazione precisa tra le proteine amiloidi e il morbo di Alzheimer, che colpisce circa 50 milioni di persone in tutto il mondo. Ad oggi, non esiste una cura e nessun farmaco in grado di prevenire o invertire i sintomi della malattia di Alzheimer.
“Quando viene diagnosticata la malattia di Alzheimer, la maggior parte del danno neurologico è fatto ed è probabilmente troppo tardi per invertire la progressione della malattia”, dice Rajini Rao, Professore di fisiologia presso la Johns Hopkins University School of Medicine. “Ecco perché dobbiamo concentrarci sui primi sintomi patologici o sui marcatori della malattia di Alzheimer, e sappiamo che la biologia e la chimica degli endosomi è un fattore importante molto tempo prima che si instauri il declino cognitivo“.
Quasi 20 anni fa, gli scienziati della Johns Hopkins e della New York University hanno scoperto che gli endosomi, compartimenti circolari che trasportano il carico all’interno delle cellule, sono più grandi e molto più abbondanti nelle cellule cerebrali di persone destinate a sviluppare la malattia di Alzheimer. ” Questo ha suggerito che esiste un problema di fondo negli endosomi che potrebbe portare ad un accumulo di proteina amiloide negli spazi intorno ai neuroni”, dice Rao.
Per trasportare il loro carico da un posto all’altro, gli endosomi usano chaperon-proteine che si legano a carichi specifici e li portano avanti e indietro dalla superficie della cellula. Se e quanto bene questo legame si verifica dipende dal giusto livello di pH all’interno dell’endosoma, un delicato equilibrio di acidità e alcalinità, o acido e base, che fa galleggiare gli endosomi in superficie e scivolare giù nella cellula.
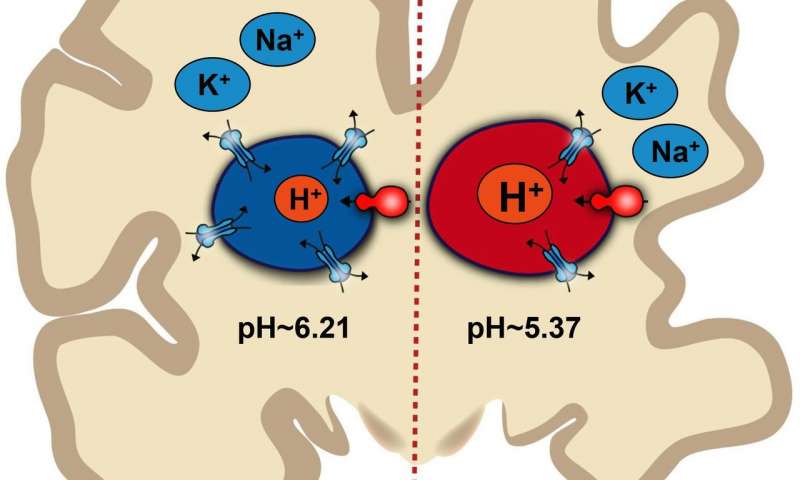
Incorporate nella membrana endosomiale dentro e fuori gli endosomi, ci sono le proteine caricate di atomi di idrogeno, note come protoni. La quantità di protoni all’interno dell’endosoma determina il suo pH.
Quando i fluidi nell’endosoma diventano troppo acidi, il carico viene intrappolato all’interno dell’endosoma, in profondità all’interno della cellula. Quando il contenuto di endosoma è più alcalino, il carico rimane a lungo sulla superficie della cellula.
Per determinare se tali squilibri di pH si verificano nella malattia di Alzheimer, Hari Prasad ha setacciato studi scientifici sulla malattia di Alzheimer alla ricerca di geni che sono stati selezionati nei cervelli malati rispetto a quelli normali. Confrontando un set di dati di 15 cervelli dei pazienti con malattia di Alzheimer con 12 normali, ha scoperto che 10 dei 100 geni più frequentemente regolati erano correlati al flusso di protoni nella cellula.
In un altro gruppo di campioni di tessuto cerebrale di 96 persone con malattia di Alzheimer e 96 sane, l’espressione genica del protone shuttle negli endosomi, nota come NHE6, era di circa il 50% più bassa nelle persone con malattia di Alzheimer rispetto a quelle con cervello normale. Nelle cellule cresciute da persone con malattia di Alzheimer e in astrociti di topo progettati per trasportare una variante del gene della malattia di Alzheimer umano, la quantità di NHE6 era circa la metà della quantità trovata nelle cellule normali.
Per misurare l’equilibrio del pH all’interno degli endosomi senza rompere l’astrocita, Prasad e Rao hanno utilizzato sonde sensibili al pH che sono assorbite dagli endosomi ed emettono luce in base ai livelli di pH. Hanno scoperto che le linee cellulari di topo contenenti la variante del gene della malattia di Alzheimer presentavano più endosomi acidi (una media di 5,37 pH) rispetto alle linee cellulari senza la variante del gene (media di 6,21 pH).
“Senza il corretto funzionamento di NHE6, gli endosomi diventano troppo acidi e indugiano all’interno degli astrociti, evitando i loro doveri di eliminare le proteine beta dell’amiloide“, dice Rao.
Mentre è probabile che i cambiamenti in NHE6 avvengano nel tempo in persone che sviluppano sporadica malattia di Alzheimer, le persone che hanno ereditato le mutazioni in NHE6 sviluppano quella che è conosciuta come sindrome di Christianson durante l’infanzia e hanno una rapida degenerazione cerebrale.
Prasad e Rao hanno anche scoperto che una proteina chiamata LRP1, che raccoglie proteine beta amiloide all’esterno dell’astrocita e le consegna agli endosomi, era la metà in abbondanza sulla superficie degli astrociti di topo coltivati in laboratorio, ingegnerizzati con una variante del gene umano chiamata APOE4, comunemente legata a Il morbo di Alzheimer.
Alla ricerca di modi per ripristinare la funzione di NHE6, Prasad ha cercato database di studi sui lieviti e scoperto che gli inibitori HDAC tendono ad aumentare l’espressione del gene NHE6 nel lievito. Questo gene è molto simile tra le specie, incluse mosche, topi e umani.
Prasad e Rao hanno testato nove tipi di inibitori HDAC su colture cellulari di astrociti di topo progettati con la variante del gene APOE4. Gli inibitori HDAC ad ampio spettro hanno aumentato l’espressione di NHE6 ai livelli associati agli astrociti di topo che non avevano la variante genetica dell’Alzheimer. Hanno anche scoperto che gli inibitori di HDAC hanno corretto lo squilibrio del pH all’interno degli endosomi e ripristinato LRP1 sulla superficie dell’astrocita, con conseguente clearance efficace della proteina beta amiloide.
Fonte: PNAS