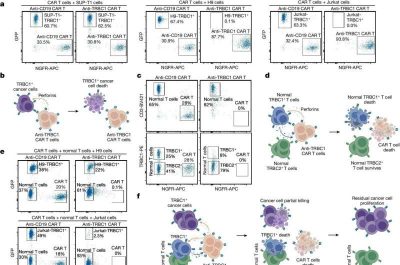
Leucemie-Immagine: l’attività delle cellule T CAR anti-TRBC1 è limitata dalla normale uccisione delle cellule T CAR mediata dalle cellule T. Credito: Natura (2024).
Un nuovo trattamento per leucemie e linfomi che derivano dalle cellule T del sistema immunitario, sviluppato dai ricercatori del Johns Hopkins Kimmel Cancer Center e del suo Ludwig Center e Lustgarten Laboratory, si è rivelato efficace nell’uccidere questi tumori nei topi portatori di tumori a cellule T umane.
La terapia, un coniugato anticorpo-farmaco (ADC), combina un anticorpo che prende di mira una proteina chiamata TRBC1 espressa sulla superficie dei tumori delle cellule T con un farmaco antitumorale chiamato SG3249. L’ADC funziona utilizzando l’anticorpo per cercare le cellule tumorali che esprimono TRBC1. Quindi, quelle cellule tumorali ingeriscono l’ADC, dove viene rilasciato SG3249 che uccide le cellule tumorali.
Una descrizione dello studio è stata pubblicata su Nature.
Ogni anno, circa 100.000 pazienti in tutto il mondo sono affetti da leucemie e linfomi a cellule T. Gli adulti con tumori a cellule T recidivanti hanno opzioni terapeutiche limitate e tassi di sopravvivenza a cinque anni del 7-38%.
“Sviluppare trattamenti per le leucemie e i linfomi a cellule T è molto più difficile che per le leucemie e i linfomi derivanti dalle cellule B del sistema immunitario”, spiega l’autore senior dello studio Suman Paul, MBBS, Ph.D., assistente Professore di oncologia alla Johns Hopkins University, Scuola Universitaria di Medicina.
Terapie efficaci per i tumori a cellule B eliminano sia le cellule B cancerose che quelle non cancerose, ma i pazienti continuano a stare bene anche senza le cellule B del sistema immunitario che aiutano a combattere le infezioni. Tuttavia, se si utilizzassero approcci simili e un trattamento eliminasse sia le cellule T normali che quelle cancerose, lascerebbe i pazienti senza un sistema immunitario funzionante e ad alto rischio di morte a causa di infezioni.
“Non sono stati sviluppati molti farmaci in questo ambito di leucemie e linfomi a cellule T”, afferma Paul. “Abbiamo bisogno di nuove terapie per questi tumori, ma qualunque terapia sviluppiamo deve essere specifica per il cancro. Dobbiamo preservare alcune delle cellule T normali e spazzare via le cellule T cancerose allo stesso tempo“.
I tumori a cellule T esprimono TRBC1 o TRBC2, mentre le cellule T normali esprimono un mix di TRBC1 e TRBC2. Pertanto, il target selettivo di TRBC1 può potenzialmente sradicare le cellule T normali e cancerose che esprimono TRBC1 preservando le cellule T normali che esprimono TRBC2. Un recente studio clinico condotto altrove ha tentato di colpire i tumori TRBC1 utilizzando la terapia con cellule T del recettore dell’antigene chimerico (CAR).
Queste cellule T CAR sono cellule T geneticamente modificate che si legano e uccidono le cellule TRBC1. Le terapie con cellule CAR T sono opzioni terapeutiche approvate dalla FDA utilizzate in diversi tumori a cellule B. Tuttavia, dopo aver somministrato la terapia con cellule CAR T mirate a TRBC1 in pazienti umani, i ricercatori dello studio hanno riferito che le cellule CAR T non persistevano all’interno dei pazienti.
Tale persistenza è necessaria per un’efficace uccisione delle cellule tumorali. Interessati a capire perché, Paul e colleghi hanno scoperto che le cellule T CAR che prendono di mira TRBC1 potrebbero essere uccise dalle cellule T normali, limitandone la persistenza.
Questa mancanza di persistenza delle cellule T CAR ha portato il team a provare il target TRBC1 con l’uso di coniugati farmaco-anticorpo. Paul e colleghi hanno provato due diverse formulazioni di ADC in modelli murini di tumori a cellule T. Dopo una singola iniezione di una formulazione del trattamento, i tumori inizialmente regredivano ma poi si ripresentavano. Dopo un singolo trattamento con la combinazione ADC anti-TRBC1-SG3249, i ricercatori hanno osservato segni di eliminazione del cancro entro sette giorni e alla fine i tumori non erano più rilevabili, senza recidive.
“I tumori non si sono ripresentati e abbiamo seguito i topi per più di 200 giorni“, spiega Paul.
Il trattamento è stato in grado di eliminare il cancro preservando la metà delle restanti cellule T normali. “Le cellule T normali residue dovrebbero essere sufficienti a mantenere una certa protezione del sistema immunitario contro le malattie infettive“, afferma Paul.
Spiegano gli autori:
“Le terapie mirate mediate dalle cellule T con anticorpi e recettori chimerici dell’antigene (CAR) hanno migliorato la sopravvivenza nei pazienti affetti da tumori maligni solidi ed ematologici. Gli adulti affetti da leucemie e linfomi a cellule T, collettivamente chiamati tumori a cellule T, hanno una sopravvivenza breve e non dispongono di terapie mirate. Pertanto, i tumori a cellule T garantiscono in particolare lo sviluppo di cellule T CAR e di anticorpi per migliorare i risultati dei pazienti. Studi preclinici hanno dimostrato che prendere di mira la regione 1 della costante della catena β del recettore delle cellule T (TRBC1) può uccidere le cellule T cancerose preservando al contempo un numero sufficiente di cellule T sane per mantenere l’immunità, rendendo TRBC1 un bersaglio attraente per il trattamento dei tumori delle cellule T. Tuttavia, il primo studio clinico condotto sull’uomo sulle cellule T CAR anti-TRBC1 ha riportato un basso tasso di risposta e una perdita inspiegabile di cellule T CAR anti-TRBC1. Qui dimostriamo che le cellule T CAR vengono perse a causa dell’uccisione da parte delle cellule T normali del paziente, riducendone l’efficacia. Per aggirare questo problema, abbiamo sviluppato un coniugato anticorpo-farmaco che potrebbe uccidere le cellule tumorali TRBC1 + in vitro e curare i tumori delle cellule T umane nei modelli murini. Il coniugato anticorpo-farmaco anti-TRBC1 può fornire un formato ottimale per il target di TRBC1 e produrre risposte superiori nei pazienti con tumori a cellule T“.
“Assistere all’eliminazione riuscita dei tumori delle cellule T risparmiando le cellule T normali in modelli preclinici è stato davvero gratificante“, aggiunge Jiaxin Ge, coautore dello studio e dottorando al terzo anno al Ludwig Center. “Crediamo che questo approccio abbia il potenziale per rispondere a un’esigenza critica insoddisfatta in oncologia e ci impegniamo a portarla avanti attraverso ulteriori ricerche”.
Leggi anche:Leucemie: anticorpi e farmaci per combatterle
Tushar Nichakawade, primo autore dello studio e dottorando di ricerca al quarto anno presso il Ludwig Center, afferma: “Ci sono così tante lezioni da imparare dalla clinica ed è stato emozionante far parte del processo iterativo di scoperta di farmaci. Ogni terapia ha i suoi pro e contro, ma l’efficacia preclinica di il nostro ADC mi fa sperare che possa fare la differenza per i pazienti affetti da questi terribili tumori”.
Fonte:Nature