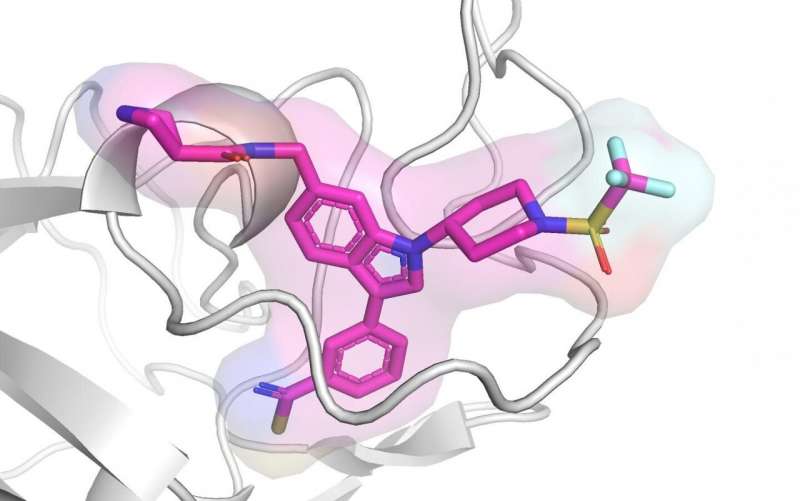
(Leucemia-Immagine:cristallografia a raggi X che mostra un inibitore ASH1L sviluppato dallsa UM in complesso con la proteina. Credito: Grembecka / Cierpicki Labs).
La proteina prodotta dal gene ASH1L svolge un ruolo chiave nello sviluppo della leucemia acuta, insieme ad altre malattie. La proteina ASH1L, tuttavia, è difficile da bersagliare terapeuticamente.
Ora un team di ricercatori guidato da Jolanta Grembecka, Ph.D. e Tomasz Cierpicki, Ph.D., dell’Università del Michigan ha sviluppato per inibire il dominio SET di ASH1L, prevenendo interazioni molecolari critiche nel sviluppo e progressione della leucemia.
Le scoperte del team è stata pubblicata in Nature Communications.
Nei modelli murini di leucemia a lignaggio misto, il composto inibitore principale, noto come AS-99, ha ridotto con successo la progressione della leucemia.
“Questo lavoro punta a una nuova strada per sviluppare nuovi agenti terapeutici contro la leucemia acuta, oltre a fornire un nuovo approccio per studiare ulteriormente le funzioni biologiche di ASH1L e il suo ruolo nello sviluppo della malattia”, afferma Grembecka, Professore associato di patologia presso la Michigan Medicine e co-Direttore del programma di terapia evolutiva presso l’UM Rogel Cancer Center.
Vedi anche:Leucemia: nuova strada per l’eradicazione
Spiegano gli autori:
“In questo studio, abbiamo convalidato il ruolo del dominio catalitico ASH1L SET nella leucemia. È importante sottolineare che i topi carenti di Ash1Lo con una perdita del dominio Ash1l SET sono rimasti vitali senza difetti di sviluppo importanti, suggerendo che il target di ASH1L potrebbe avere effetti collaterali limitati o nulli e supportare ASH1L come bersaglio attraente per la scoperta di farmaci. Tuttavia, ASH1L è un obiettivo impegnativo per lo sviluppo di inibitori poiché il dominio SET adatta una conformazione inattiva con il ciclo autoinibitorio che blocca l’accesso al sito attivo. Applicando lo screening basato sui frammenti, seguito da un design basato sulla struttura, abbiamo sviluppato i potenti inibitori ASH1L, tra cui AS-99 (IC50 = 0,79 µM, K d = 0,89 µM). L’applicazione sistematica di studi biochimici, biofisici e strutturali ha prodotto inibitori di ASH1L con un’affinità di legame migliorata di oltre 1000 volte rispetto al frammento colpito inizialmente. Pertanto, il nostro studio rivela la trattabilità del dominio ASH1L SET per l’inibizione da parte di piccole molecole, poiché non erano stati segnalati tali composti prima. Studi strutturali dimostrano che gli inibitori che abbiamo sviluppato si legano a un sito adiacente al ciclo autoinibitore nel dominio SET, possibilmente stabilizzando la conformazione in questa regione e bloccando allostericamente l’attività enzimatica di ASH1L. Quando testato in cellule di leucemia MLL, AS-99 ha sottoregolato l’espressione dei geni target di fusione MLL e ha ridotto la dimetilazione di H3K36, supportando fortemente un meccanismo d’azione sul bersaglio. L’analisi GSEA ha rivelato che l’ AS-99 sopprimeva i programmi trascrizionali guidati dalle proteine di fusione MLL e HOXA9 . Il trattamento con AS-99 ha anche inibito la proliferazione e indotto la differenziazione e l’apoptosi nelle cellule leucemiche MLL, ma non nelle linee cellulari di controllo senza traslocazione MLL1. In sintesi, il composto AS-99 che riportiamo qui rappresenta un inibitore ASH1L primo della categoria, ben caratterizzato e selettivo con attività in vitro sub-micromolare. Questo composto può servire come una preziosa sonda chimica per esplorare ulteriormente le funzioni biologiche di ASH1L e per affrontare un potenziale beneficio terapeutico del blocco di ASH1L in diverse malattie, incluso il cancro. Il risultato di questi studi aprirà la strada allo sviluppo di agenti farmacologici mirati al dominio SET catalitico di ASH1L”.
Lo studio è stato una stretta collaborazione tra il laboratorio di Grembecka e il laboratorio dell’autore co-senior Cierpicki, Professore associato di biofisica e patologia.
Fonte: Nature