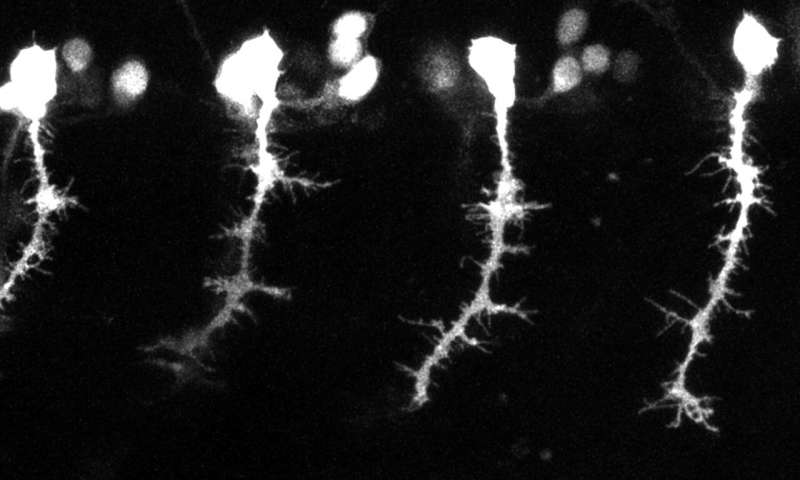
Immagine: neuroni dello zebrafish, in cui i ricercatori di Harvard hanno testato il loro approccio per la crescita diretta degli assoni. Credito: Arlotta Laboratory / Harvard University.
I ricercatori dell’Università di Harvard hanno sviluppato una tecnica di ingegneria per controllare con precisione la direzione in cui i neuroni fanno crescere i loro assoni, strutture simili a cavi che consentono alle cellule nervose di connettersi tra loro.
In un modello di pesce zebra, i ricercatori hanno utilizzato il loro approccio per correggere le connessioni neurali difettose e ripristinare la capacità del neurone di causare contrazioni muscolari.
I risultati dello studio, pubblicati sulla rivista Developmental Cell, rappresentano un passo fondamentale verso la riparazione dei danni al sistema nervoso nei pazienti. Possono anche consentire agli scienziati di creare modelli più accurati del cervello in un piatto di laboratorio, per riprodurre la formazione di connessioni neuronali precise, simili a quelle del cervello reale.
“Il processo di stabilire connessioni tra i neuroni si verifica principalmente durante lo sviluppo embrionale, specialmente nei mammiferi come noi. Dopo quel momento, se queste connessioni sono interrotte in situazioni come lesioni del midollo spinale, i neuroni in genere non ricrescono le loro connessioni, perdendo funzionalità. Sarebbe un grande risultato essere in grado di superare queste difficoltà “, ha dichiarato Paola Arlotta, Professore specializzato in biologia rigenerativa. “Questo studio è una prova di principio che mostra il potenziale di una strategia non invasiva per dirigere la crescita dei neuroni”.
Formare connessioni neurali
L’assone di un neurone è una proiezione che emana dal corpo cellulare e si collega ad altre cellule, spesso localizzate a grande distanza. Nell’embrione in via di sviluppo, un complesso set di segnali guida una struttura specializzata sulla punta dell’assone, chiamata cono di crescita, verso il suo preciso obiettivo di collegare il sistema nervoso.
“La natura ha creato questa meravigliosa sinfonia di segnalazione molecolare che consente a un tessuto incredibilmente complesso come il cervello di collegarsi in modo appropriato. Stiamo imparando sempre di più su come ciò accade, ma non abbiamo ancora la capacità di dirigere tutti questi processi complessi “, ha dichiarato James Harris, un laureato nel laboratorio di Arlotta e autore principale dello studio. “Invece, abbiamo creato uno strumento estremamente preciso che ci consente di sovrascrivere i segnali molecolari all’interno del corpo e guidare la crescita assonale, secondo i nostri progetti“.
Controllando direttamente la crescita assonale, questa strategia evita di interrompere la segnalazione biologica di molecole critiche e impedisce la produzione di sostanze chimiche che potrebbero alterare il delicato ambiente di sviluppo e che potrebbero potenzialmente causare conseguenze indesiderate sulle cellule vicine. Per assicurarsi che lo strumento fosse altamente specifico, i ricercatori hanno adottato un approccio ingegneristico al problema.
Un approccio ingegneristico non invasivo
Per controllare la crescita degli assoni, i ricercatori hanno introdotto una proteina di fusione in neuroni specifici che combinava la funzionalità di due diverse proteine. La prima proteina viene normalmente espressa nello sviluppo di assoni e controlla i meccanismi responsabili della crescita assonale. La seconda proteina si trova originariamente nelle piante e le aiuta a percepire la luce.
“Nel modo in cui le piante mentre crescono ruotano verso il sole, abbiamo progettato gli assoni in modo che crescano verso la nostra illuminazione mirata”, ha detto Harris. Quando i ricercatori hanno fatto brillare un tipo specifico di luce vicino ai neuroni, gli assoni sono cresciuti verso lo stimolo luminoso non invasivo. I ricercatori hanno testato l’approccio in un modello di pesce zebra, in collaborazione con il laboratorio Leonard Zon. Sono stati in grado non solo di far crescere i neuroni in una direzione prescelta, ma anche di farli crescere attraverso repulsive barriere allo sviluppo che normalmente limitano gli assoni a una posizione corporea molto stretta.
“Ci sono molecole specifiche che sono espresse in queste barriere dello sviluppo che aiutano a guidare correttamente gli assoni durante lo sviluppo normale. È interessante notare che molte di queste molecole sono presenti anche nei tessuti danneggiati e fungono da barriere alla rigenerazione assonale nei mammiferi”, ha detto Harris. “In questo particolare contesto di sviluppo di un embrione di pesce zebra, il nostro approccio ha avuto il potere di superare queste molecole di segnalazione inibitoria“.
I ricercatori hanno anche studiato un modello di pesce zebra con mutazioni genetiche che impedivano la corretta crescita degli assoni. Il loro approccio con l’illuminazione ha salvato con successo questo difetto guidando gli assoni verso i loro obiettivi. Gli assoni guidati sono stati in grado di causare contrazioni muscolari nel pesce zebra, dimostrando che le connessioni riparate erano funzionali.
Applicazione della tecnologia
Sebbene l’applicazione di questa tecnologia per riparare le connessioni danneggiate nei pazienti richieda un notevole lavoro aggiuntivo, questo studio è un passo promettente in questa importante direzione. Più immediatamente, la nuova tecnica può aiutare gli scienziati a creare modelli più accurati del cervello. “Siamo davvero interessati a utilizzare questa tecnologia per collegare connessioni più specifiche all’interno degli organoidi del cervello umano”, ha detto Arlotta. Realizzati con cellule staminali umane, gli organoidi replicano importanti caratteristiche del sistema nervoso in via di sviluppo in un piatto da laboratorio. “Gli organoidi cerebrali possono riprodurre un gran numero di tipi di cellule che normalmente popolano il cervello endogeno. Sebbene questi neuroni possano estendere assoni e fili all’interno dei circuiti, al momento, la loro connettività non è organizzata come quella del cervello reale”, ha detto Arlotta. “Guidando gli assoni di neuroni specifici verso obiettivi predefiniti, avremmo l’opportunità di progettare una nuova connettività, esattamente come quella presente nell’organismo intatto. Questo è importante per molte ragioni, non ultimo la possibilità di capire come le malattie influenzano determinati neuroni e le loro reti per informare il progresso terapeutico “.
Fonte: Developmental Cell