Cancro-immagine credit public domain.
In uno studio recente pubblicato su Nature, Baldwin, JG, Silveira, CRF e Gattinon, della Divisione di modulazione funzionale delle cellule immunitarie, Istituto Leibniz per l’immunoterapia, Ratisbona, Germania, dimostrano che il microambiente tumorale (TME) limita le risposte delle cellule T CD8 + infiltranti il tumore, limitando l’assorbimento e l’utilizzo degli acidi grassi attraverso la soppressione della transgelina 2 (TAGLN2) indotta dallo stress del reticolo endoplasmatico (ER).
La sovraespressione di TAGLN2 nelle cellule T CD8 + bypassa la risposta allo stress dell’ER, ripristinando il trasporto degli acidi grassi, l’idoneità bioenergetica e l’efficacia antitumorale.
Il generale Dwight D. Eisenhower una volta affermò che battaglie, campagne e persino guerre, vengono vinte o perse principalmente a causa della logistica. Ottenere le risorse giuste dove devono essere al momento giusto è fondamentale per determinare il successo sul campo di battaglia.
La lotta contro il cancro non richiede requisiti meno simili.
Le cellule T CD8 + sono i soldati in prima linea incaricati di colpire ed eliminare le cellule tumorali. Tuttavia, quando operano dietro le linee nemiche nel TME, un territorio ostile in cui ossigeno e nutrienti sono scarsi, le cellule T sono costrette a cercare e persino a competere direttamente con le cellule tumorali per le risorse, inclusi gli acidi grassi, per sostenere la loro sopravvivenza e funzione.
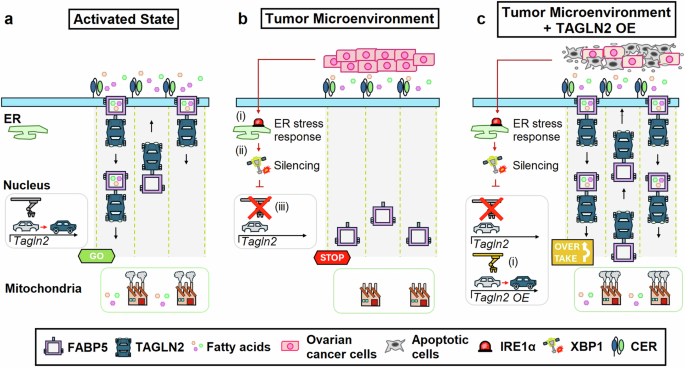
In questo studio, i ricerrcatori dimostrano che TAGLN2 interagisce con la proteina legante gli acidi grassi 5 (FABP5) per facilitarne la localizzazione sulla superficie cellulare. Insieme, queste due proteine cooperano per ottimizzare l’importazione degli acidi grassi nelle cellule T CD8 + per il metabolismo dei lipidi e la β-ossidazione nei mitocondri (Fig. 1a ). Tuttavia, il tumore impiega una strategia intelligente per disattivare questa vitale linea di rifornimento. Il gruppo ha scoperto che il TME silenzia l’espressione di TAGLN2, bloccando efficacemente l’assorbimento degli acidi grassi nelle cellule T CD8 + .
Sono stati identificati diversi siti di legame dei presunti fattori di trascrizione associati allo stress del reticolo endoplasmatico (ER) nel locus promotore Tagln2. Attraverso l’uso di topi transgenici deficienti, gli autori hanno identificato una cascata di eventi molecolari che mediano la repressione di Tagln2 : (i) attivazione dell’enzima 1α (IRE1α) che richiede inositolo che (i) media lo splicing della proteina legante il fattore di trascrizione X-box 1 (XBP1) nella sua isoforma attiva e (iii) consente a XBP1 di legarsi saldamente alle regioni promotrici di Tagln2 (Fig. 1b). Sorprendentemente, i ricercatori sono stati in grado di salvare le cellule T CD8 + stressate dal RE sovraesprimendo TAGLN2, che ha riattivato l’assorbimento dei lipidi, con conseguente aumento della respirazione mitocondriale, della produzione di citochine e della citotossicità.
La sovraespressione della transgelina 2 nelle cellule T ingegnerizzate con recettori endocrini chimerici ripristina l’assorbimento degli acidi grassi e migliora la funzione antitumorale. a Una volta attivate, le cellule T ingegnerizzate con recettori endocrini chimerici (CER) aumentano l’espressione della transgelina 2 (TAGLN2). TGLN2 facilita il traffico della proteina legante gli acidi grassi 5 (FABP5) sulla superficie della membrana delle cellule T, consentendo l’importazione e il traffico intracellulare di acidi grassi esogeni nei mitocondri dove vengono utilizzati per la generazione di energia tramite β-ossidazione. b Nel microambiente tumorale del cancro ovarico, lo stress del reticolo endoplasmatico (ER) induce (i) l’attivazione dell’enzima 1α che richiede inositolo (IRE1α), che (ii) media lo splicing del fattore di trascrizione proteina legante X-box 1 (XBP1) nella sua isoforma attiva, che quindi (iii) reprime l’espressione di Tagln2 . Il silenziamento di TAGLN2 impedisce la localizzazione superficiale di FABP5, inibendo l’assorbimento degli acidi grassi e riducendo l’idoneità metabolica delle cellule T ingegnerizzate con CER. c La sovraespressione (OE) di TAGLN2 (i) bypassa il silenziamento mediato dallo stress del reticolo endoplasmatico, migliorando l’assorbimento degli acidi grassi, l’idoneità metabolica e la funzione antitumorale delle cellule T ingegnerizzate con CER
Per esplorare ulteriormente il potenziale terapeutico della sovraespressione di TAGLN2, i ricercatori hanno sottoclonato il gene Tagln2 a valle di un costrutto di recettore endocrino chimerico (CER), che ha come bersaglio i tumori ovarici positivi al recettore dell’ormone follicolo-stimolante (FSHR + ). Le cellule T CER-TAGLN2 risultanti si sono infiltrate in modo più efficiente nelle lesioni metastatiche e hanno controllato efficacemente la progressione della malattia in un modello murino di carcinoma tubo-ovarico sieroso di alto grado (HGSC) che ospita le mutazioni genetiche più frequenti rilevate nei pazienti con carcinoma ovarico sieroso di alto grado.
Le cellule T CER-TAGLN2 infiltranti il tumore hanno mantenuto un’elevata espressione di TAGLN2 e livelli superficiali di FABP5 rispetto alle cellule T CER di controllo presenti negli stessi siti tumorali. È interessante notare che il blocco PD-1 non ha potenziato gli effetti terapeutici delle cellule T CER-TAGLN2, portando gli autori a concludere che il silenziamento di TAGLN2 ha compromesso la capacità delle cellule T CER di controllare i tumori ovarici avanzati.
È importante sottolineare che, mentre gli autori dimostrano un miglioramento nell’assorbimento degli acidi grassi, che potenzialmente contribuisce al metabolismo potenziato delle cellule T CD8 + nel TME, non è ancora chiaro se questo meccanismo sia direttamente alla base dei risultati terapeutici migliorati osservati nelle cellule T CER-TAGLN2.
Per comprendere meglio i contributi specifici del metabolismo degli acidi grassi, la sovraespressione di TAGLN2 nelle cellule T CER con deficit di FABP5 potrebbe fungere da importante controllo, aiutando a chiarire se l’effetto antitumorale di TAGLN2 è principalmente guidato dal metabolismo dei lipidi o da altri meccanismi.
Dato il limitato successo clinico delle terapie con cellule T nei tumori solidi, in particolare nel carcinoma ovarico metastatico, c’è un’urgente necessità di sviluppare strategie per fortificare le cellule T e migliorare la loro capacità di prosperare nell’ostile TME. Altri gruppi hanno esplorato approcci complementari per mitigare lo stress dell’ER nelle cellule T. Ad esempio, l’inibizione farmacologica di XBP1 o il target di altri sensori a valle dello stress dell’ER, come la proteina omologa C/EBP (CHOP) e la proteina chinasi R-like endoplasmic reticulum kinase (PERK)/endoplasmic reticulum ossidoreduttasi 1 alfa (ERO1α), hanno dimostrato di migliorare la funzione effettrice delle cellule T CD8 + reattive al tumore.
L’intuitivo lavoro dei ricercatori aggiunge un altro entusiasmante tassello al puzzle per superare le sfide dello stress dell’ER nella TME. Sarà interessante vedere se queste diverse strategie di intervento potrebbero essere combinate e agire sinergicamente per estendere ulteriormente l’efficacia delle cellule T contro il cancro ovarico e altri tumori solidi. Il lavoro futuro dovrebbe anche concentrarsi sulla spiegazione della natura dei segnali nel TME che innescano la risposta allo stress dell’ER che porta alla downregulation di TAGLN2, nonché sulla determinazione se gli stessi meccanismi di immunosoppressione mediata dal TME influenzano altri sottogruppi di cellule immunitarie.
Infine, quando si considerano strategie militari, è essenziale adottare una visione olistica dell’intera catena di fornitura verticale piuttosto che concentrarsi esclusivamente sugli elementi di trasporto. Se, ad esempio, il TME danneggia o distrugge anche le fabbriche delle cellule (ad esempio i mitocondri), le cellule potrebbero non essere in grado di utilizzare efficacemente le risorse anche se le forniture raggiungono la loro destinazione. In tali casi, combinare la sovraespressione di TAGLN2 con tecnologie emergenti, come il trasferimento mitocondriale o terapie mirate che proteggono/promuovono la biogenesi dei mitocondri, potrebbe ripristinare o migliorare l’ossidazione degli acidi grassi, consentendo alle cellule T di ottenere una migliore efficacia antitumorale.
Legg anche:Come il cancro inganna le difese immunitarie
In sintesi, Hwang et al. hanno dimostrato che la battaglia contro il cancro è tanto una sfida logistica quanto una lotta di potenza di fuoco, evidenziando l’importanza di garantire risorse metaboliche alle cellule T per garantire il successo nella lotta contro il cancro. Assicurandoci che le linee di rifornimento degli acidi grassi rimangano aperte, possiamo dare potere alle cellule T per svolgere il loro ruolo vitale sulle linee del fronte ostile del microambiente tumorale, aprendo in definitiva la strada a immunoterapie oncologiche più efficaci per i pazienti.
Fonte:Nature