Secondo un nuovo studio, la soppressione di un segnale chimico può bloccare la fibrosi.
Un corpo ferito cerca sempre di guarire, ma questo processo è tutt’altro che semplice. Una miriade di cellule si organizzano per ripristinare ciò che è stato danneggiato. Poi, in modo critico, il processo si assottiglia. E quando non è così, gli effetti possono essere disastrosi. La fibrosi è l’ispessimento e cicatrizzazione del tessuto a causa di una risposta di guarigione iperattiva.
” Secondo le statistiche, il 45 per cento di tutti i decessi nel mondo possono essere attribuiti a un disturbo con un link alla fibrosi che si può sviluppare praticamente in qualsiasi tessuto o organo del corpo””, dice Edward Leof, autore di un articolo pubblicato nel Journal of Clinical Investigation e co-leader della the Immunity and Fibrosis platform nel Centro Mayo Clinic for Biomedical Discovery.
( Vedi anche:Identificato un percorso che induce la fibrosi in molti organi).
Nell’intestino, la fibrosi può essere collegata alla malattia infiammatoria intestinale. Può danneggiare il fegato dopo la guarigione da infezioni virali o eccessivo consumo di alcol. Il glaucoma e la degenerazione maculare sono forme di fibrosi negli occhi. E, nei polmoni, la fibrosi gioca un ruolo nello sviluppo dell’ asma e broncopneumopatia cronica ostruttiva. Il processo di fibrosi riempie le arterie con tappi fibrotici (aterosclerosi). Induce inoltre il tessuto cicatriziale a sviluppare una malattia chiamata disturbo cheloide, una tumore benigno della pelle caratterizzato da crescita anormale di tessuto fibrotico.
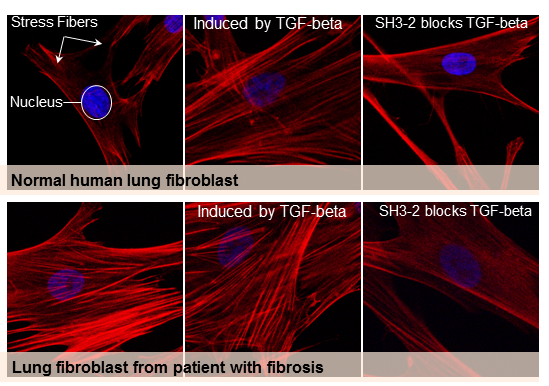
Targeting TGF-beta blocca la fibrosi
TGF-beta è un fattore di crescita importante per una serie di attività cellulari. E’ la molecola di segnalazione cellulare più pro-fibrotica nota. TGF-beta è indicata come un interruttore principale nella genesi della fibrosi. Il Dr. Leof e il suo team hanno identificato un nuovo approccio per modulare le azioni fibrotiche connesse a TGF-beta, bloccando una proteina chiave chiamata SMAD3.
Le proteine SMAD lavorano all’interno delle cellule per leggere i messaggi trasmessi da cellula-a-cellula e rispondere attivando la trascrizione del gene. In un complesso con altre proteine chiamate SNX9, SMAD3 attraversa il nucleo della cellula e inizia a interagire con i geni per promuovere TGF-beta pro-fibrotico.
Per bloccare SMAD3 e prevenire la risposta di TGF-beta, il team del Dr. Leof ha fuso un frammento della proteina SNX9 con una breve catena di amminoacidi specificamente progettata per trasportare un carico di proteine nella cellula. Quando il frammento di SNX9 si lega a SMAD3, impedisce al complesso SMAD3 di entrare nel nucleo e attivare o spegnere i geni regolati da TGF-beta.
Gli autori hanno testato l’effetto di questa strategia in colture di cellule umane e di topo, così come in due modelli animali di fibrosi polmonare.
A causa della complessità di TGF-beta – che stimola e sopprime geni che regolano una serie di importanti processi fisiologici – i farmaci che agiscono su tutte le azioni di TGF-beta hanno generalmente effetti collaterali inaccettabili ed è per questo che non esiste alcun trattamento efficace per impedire il processo di fibrosi.
“Questo studio fornisce la prova di concetto che il target di specifiche molecole di segnalazione agisce in modo efficace sia in vitro che in vivo sul processo fibrotico controllando l’attività di TGF-beta”, spiega il Dr Leof.
Fonte: Mayo Clinic