È in atto una rivoluzione scientifica, mentre i ricercatori si impegnano per portare la precisione a livello atomico, un tempo riservata ai farmaci a piccole molecole, nel campo della nanomedicina.
Controllando attentamente la struttura delle terapie su scala nanometrica, i ricercatori stanno creando vaccini e trattamenti più efficaci contro cancro, infezioni e malattie autoimmuni. Gli scienziati stanno abbandonando il vecchio metodo “frullatore” per lo sviluppo dei vaccini in favore di approcci strutturali sofisticati, che presentano innovazioni come gli acidi nucleici sferici e i chemioflari. Queste scoperte, guidate dall’intelligenza artificiale, segnano un audace balzo in avanti nel modo in cui progettiamo la medicina alle scale più piccole e la Northwestern University è in prima linea in questo processo.
La precisione è importante: controllo a livello atomico in medicina
Per decenni, la maggior parte dei farmaci è stata realizzata con precisione atomica. L’esatta posizione di ogni atomo in una molecola di farmaco può determinarne l’efficacia e la sicurezza. Prendiamo l’ibuprofene, ad esempio: una versione della sua molecola allevia il dolore, mentre la sua immagine speculare non ha alcun effetto.
Ora, gli scienziati della Northwestern University e del Massachusetts General Brigham ritengono che questo stesso livello di precisione strutturale debba essere applicato a una nuova generazione di nanomedicine: terapie sviluppate su scala nanometrica per affrontare alcune delle malattie più gravi. A differenza dei farmaci tradizionali, le nanomedicine attuali, come i vaccini a mRNA, variano notevolmente da particella a particella. Non ce ne sono due esattamente uguali, il che può comprometterne la coerenza e l’efficacia.
Il futuro dei vaccini e della cura delle malattie
Per cambiare questa situazione, i ricercatori stanno sviluppando metodi per controllare la struttura dei nanomedicinali con maggiore precisione. Questo controllo consente agli scienziati di perfezionare il modo in cui queste terapie interagiscono con l’organismo, portando potenzialmente a vaccini più potenti e trattamenti mirati per cancro, malattie infettive, malattie neurodegenerative e malattie autoimmuni.
La loro prospettiva su questo cambiamento nella progettazione dei farmaci è stata pubblicata il 25 aprile su Nature Reviews Bioengineering.
L’eredità delle piccole molecole incontra la nanotecnologia
“Storicamente, la maggior parte dei farmaci è stata costituita da piccole molecole”, ha affermato Chad A. Mirkin della Northwestern University, coautore dell’articolo. “Nell’era delle piccole molecole, era fondamentale controllare il posizionamento di ogni atomo e di ogni legame all’interno di una particolare struttura. Se un elemento era fuori posto, poteva rendere inefficace l’intero farmaco. Ora, dobbiamo applicare questo stretto controllo alla nanomedicina. La nanomedicina strutturale rappresenta un enorme cambiamento nel nostro approccio allo sviluppo terapeutico. Concentrandoci sui dettagli complessi delle nostre terapie e su come i diversi componenti medicinali si espongono all’interno di una struttura più ampia, possiamo progettare interventi più efficaci, più mirati e, in definitiva, più benefici per i pazienti”.
Pioniere della nanomedicina, Mirkin è Professore George B. Rathmann di Chimica, Ingegneria Chimica e Biologica, Ingegneria Biomedica, Scienza e Ingegneria dei Materiali e Medicina alla Northwestern, dove ricopre incarichi presso il Weinberg College of Arts and Sciences, la McCormick School of Engineering e la Feinberg School of Medicine. È anche Direttore fondatore dell’International Institute for Nanotechnology (IIN). Mirkin è coautore di questa prospettiva con Milan Mrksich, Professore Henry Wade Rogers di Ingegneria Biomedica alla McCormick, Professore di Chimica alla Weinberg e Professore di Biologia Cellulare e dello Sviluppo alla Feinberg e con Natalie Artzi, Responsabile della nanomedicina strutturale presso il Gene and Cell Therapy Institute del Mass General Brigham, Professore Associato di Medicina alla Harvard Medical School e membro del corpo docente del Wyss Institute for Biologically Inspired Engineering presso l’Università di Harvard.
Ripensare l’approccio “Blender” ai vaccini
Negli approcci convenzionali alla progettazione di vaccini, i ricercatori si sono basati principalmente sulla miscelazione di componenti chiave. Le immunoterapie oncologiche tipiche, ad esempio, consistono in una o più molecole provenienti dalle cellule tumorali (chiamate antigeni) abbinate a una molecola (chiamata adiuvante) che stimola il sistema immunitario. I medici miscelano l’antigene e l’adiuvante fino a ottenere un cocktail e poi iniettano la miscela nel paziente.
Mirkin lo chiama “approccio frullatore”, in cui i componenti sono completamente destrutturati. In netto contrasto, le nanomedicine strutturali possono essere utilizzate per organizzare antigeni e adiuvanti. Una volta strutturate su scala nanometrica, queste stesse componenti medicinali mostrano una maggiore efficacia e minori effetti collaterali rispetto alle versioni non strutturate. Tuttavia, a differenza dei farmaci a piccole molecole, queste nanomedicine sono ancora imprecise a livello molecolare.
“Non esistono due farmaci uguali in un lotto“, ha affermato Mirkin. “I vaccini su scala nanometrica presentano quantità diverse di lipidi, diverse presentazioni dei lipidi, diverse quantità di RNA e diverse dimensioni delle particelle. Le variabili nelle formulazioni nanomediche sono infinite. Questa incoerenza porta all’incertezza. Non c’è modo di sapere se si dispone del costrutto più efficace e sicuro tra il vasto numero di possibilità.
Nanomedicina: progettare con precisione atomica
Per affrontare questo problema, Mirkin, Mrksich e Artzi propugnano un passaggio a nanomedicine strutturali ancora più precise. Con questo approccio, i ricercatori costruiscono nanomedicine a partire da strutture centrali chimicamente ben definite che possono essere ingegnerizzate con precisione con più componenti terapeutici in una disposizione spaziale controllata. Controllando la progettazione a livello atomico nella nanomedicina, i ricercatori possono sbloccare capacità senza precedenti, tra cui l’integrazione di molteplici funzionalità in un unico farmaco, l’ottimizzazione del coinvolgimento del bersaglio e il rilascio controllato del farmaco in cellule specifiche.
Casi di studio: SNA, chemoflare e megamolecole
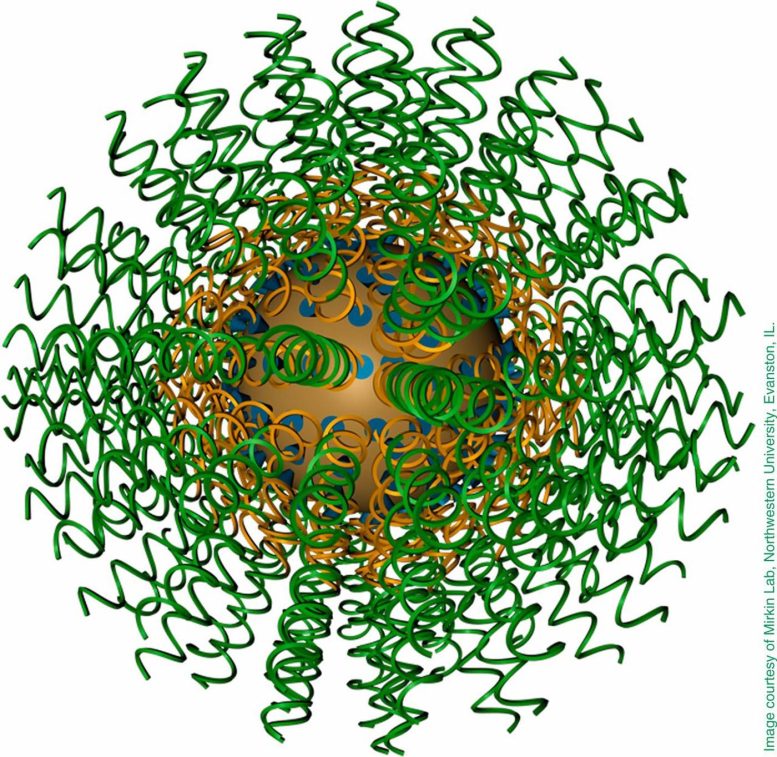
Nell’articolo, gli autori citano tre esempi di nanomedicine strutturali all’avanguardia: acidi nucleici sferici (SNA), chemioflari e megamolecole. Inventati da Mirkin, gli SNA sono una forma globulare di DNA che può facilmente penetrare nelle cellule e legarsi ai bersagli. Più efficaci del DNA lineare della stessa sequenza, gli SNA hanno dimostrato un potenziale significativo nella regolazione genica, nell’editing genetico, nella somministrazione di farmaci e nello sviluppo di vaccini, arrivando persino a curare forme mortali di cancro della pelle in ambito clinico.
“Abbiamo dimostrato che la presentazione strutturale complessiva di un vaccino o di un trattamento terapeutico a base di SNA – non semplicemente i componenti chimici attivi – ne influenza notevolmente la potenza“, ha affermato Mirkin. “Questa scoperta potrebbe portare a trattamenti per molti diversi tipi di cancro. In alcuni casi, l’abbiamo utilizzata per curare pazienti che non potevano essere trattati con nessun’altra terapia nota“.
Introdotte da Artzi e Mirkin, le chemoflare sono nanostrutture intelligenti che rilasciano farmaci chemioterapici in risposta a segnali correlati alla malattia nelle cellule tumorali. E le megamolecole, inventate da Mrksich, sono strutture proteiche assemblate con precisione che imitano gli anticorpi. I ricercatori possono progettare tutti questi tipi di nanomedicine strutturali per trasportare molteplici agenti terapeutici o strumenti diagnostici.
Somministrazione mirata e reattiva dei farmaci
“Sfruttando segnali tissutali e cellulari specifici per ogni patologia, le nanomedicine di nuova generazione possono raggiungere un rilascio di farmaco altamente localizzato e tempestivo, trasformando il modo e il luogo in cui le terapie agiscono all’interno dell’organismo”, ha affermato Artzi. “Questo livello di precisione è particolarmente critico per i trattamenti combinati, in cui la somministrazione coordinata di più agenti può migliorare notevolmente l’efficacia terapeutica, riducendo al contempo la tossicità sistemica e minimizzando gli effetti collaterali indesiderati. Questi sistemi intelligenti e reattivi rappresentano un passo avanti cruciale per superare i limiti della somministrazione convenzionale di farmaci”.
AI: il catalizzatore per l’ottimizzazione strutturale
“In futuro, i ricercatori dovranno affrontare le attuali sfide in termini di scalabilità, riproducibilità, somministrazione e integrazione di più agenti terapeutici“, affermano gli autori. Gli autori sottolineano inoltre il ruolo sempre più importante di tecnologie emergenti come l’apprendimento automatico e l’intelligenza artificiale (IA) nell’ottimizzazione dei parametri di progettazione e somministrazione.
Leggi anche:Nanomedicina: nanorobots programmati per distruggere i tumori
“Quando si analizza la struttura, a volte ci sono decine di migliaia di possibilità su come disporre i componenti nei nanomedicinali”, ha affermato Mirkin. “Con l’intelligenza artificiale, possiamo ridurre enormi quantità di strutture inesplorate a una manciata di unità da sintetizzare e testare in laboratorio. Controllando la struttura, possiamo creare i farmaci più potenti con la minima probabilità di effetti collaterali. Possiamo ristrutturare componenti medicinali come gli acidi nucleici per creare entità con proprietà che vanno ben oltre ciò che abbiamo mai visto con DNA e RNA standard. Questo è solo l’inizio e non vediamo l’ora di vedere cosa ci riserva il futuro. Siamo pronti a inaugurare un’era completamente nuova di medicina strutturale, con Northwestern in prima linea“.