(Invecchiamento-Immagine:la terapia di ringiovanimento cellulare inverte in modo sicuro i segni dell’invecchiamento nei topi. Credito: Istituto Salk).
L’invecchiamento è un processo multifattoriale progressivo che porta alla disfunzione dell’omeostasi dei tessuti e alla riduzione dell’integrità fisiologica, essendo così il fattore di rischio predominante a livello mondiale per le morbilità croniche.
È noto che la senescenza cellulare, in parte dovuta all’elevazione di un fenotipo secretorio associato alla senescenza (SASP) che media l’infiammazione locale e del sistema, esercita un ruolo causale nell’invecchiamento dell’organismo e nelle malattie legate all’età. Pertanto, lo sviluppo di interventi mirati specificamente alle cellule senescenti ha un potenziale terapeutico significativo per il miglioramento dei fenotipi dell’invecchiamento, il trattamento dei disturbi legati all’età e il miglioramento della durata della vita umana e della durata della salute (durata della vita sana).
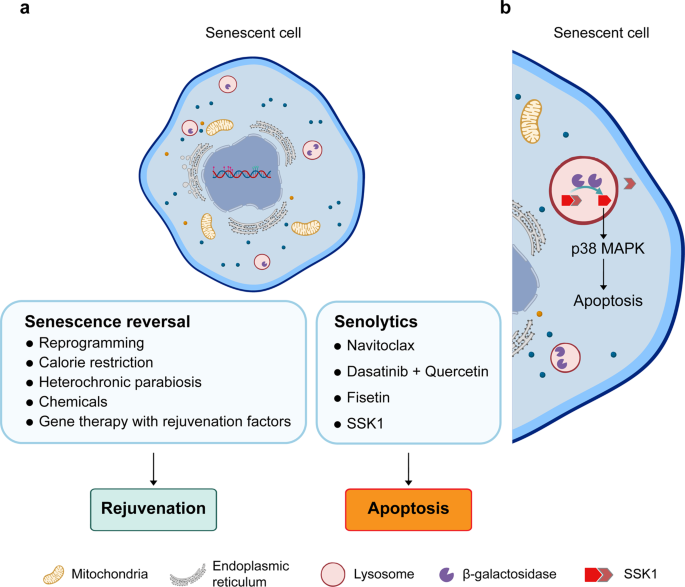
La maggior parte degli interventi sull’invecchiamento riportati rientrano in due categorie: quelli che coinvolgono processi volti a invertire l’invecchiamento cellulare modulando le vie metaboliche o l’epigenoma, e quelli che coinvolgono l’uso di fattori, i cosiddetti ‘senolitici’, per eliminare le cellule senescenti inducendo l’apoptosi (Fig.1a). Tra i primi, sia la parabiosi eterocronica (in cui animali giovani e anziani sono uniti chirurgicamente per collegare i loro sistemi circolatori) sia la restrizione calorica invertono gli effetti dell’invecchiamento fisiologico nei modelli animali, ma il loro potenziale traslazionale rimane incerto.
Allo stesso modo, la riprogrammazione transitoria con i fattori Yamanaka migliora l’invecchiamento fenotipico nei topi progeroidi. Altri approcci di target metabolico/epigenomico includono la terapia genica con fattori di ringiovanimento o l’uso di composti come Rapamicina, Oltipraz, Metformina, vitamina C e integrazione di precursori NAD + inclusi NR e NMN (Fig.1a). In un modo diverso, i senolitici mirano ad estendere la durata della salute e curare le malattie croniche legate all’età eliminando le cellule senescenti che si accumulano nei tessuti e negli organi con l’età. I composti con queste notevoli capacità includono l’inibitore Bcl-2 Navitoclax (ABT-263), Fisetina (un antiossidante) e una combinazione di Dasatinib e quercetina (aggiungendo un inibitore della tirosin-chinasi a un antiossidante) (Fig.1a). Tutti questi senolitici hanno anche potenziali limitazioni terapeutiche, tra cui il target solo di alcuni tipi di cellule senescenti e la specificità fuori bersaglio per le cellule non senescenti.
Questi dati illustrano che l’identificazione di composti con una specificità ampia, ma allo stesso tempo elevata nei confronti delle cellule senescenti è una sfida.
un diagramma schematico delle strategie che ringiovaniscono o eliminano le cellule senescenti attraverso la modulazione delle vie metaboliche e la riprogrammazione epigenetica a uno stato più giovane, o l’induzione dell’apoptosi, rispettivamente. b L’elaborazione del profarmaco SSK1 da parte del β-gal lisosomiale in un composto citotossico provoca l’attivazione della via apoptotica p38 MAPK e la clearance delle cellule senescenti.
I ricercatori della Xuanwu Hospital Capital Medical University di Pechino, Cina, hanno sfruttato una caratteristica primaria delle cellule senescenti: aumento dell’attività della β-galattosidasi lisosomiale (β-gal), che è anche un tipico biomarcatore della senescenza. Hanno progettato uno schermo che identifica i composti con una potente citotossicità per le cellule senescenti come prodotti finali e sintetizzarono nuovi profarmaci convertiti in modo univoco dal β-gal lisosomiale in composti citotossici, inducendo così l’apoptosi specificamente nelle popolazioni di cellule senescenti.
Vedi anche:Invecchiamento: nuova terapia inverte in modo sicuro i segni
Usando questo approccio, hanno sintetizzato un candidato principale SSK1, che è stato scisso da β-gal in gemcitabina citotossica in più cellule senescenti di topo e umane, ma non in cellule non senescenti. SSK1 ha ucciso selettivamente cellule senescenti sotto diversi tipi di stimoli di senescenza attraverso l’attivazione della via p38 MAPK e l’induzione dell’apoptosi (Fig. 1b ). Fondamentalmente, gli autori hanno anche dimostrato che SSK1 ha effettivamente migliorato le funzioni fisiologiche compromesse nei topi anziani e nei topi con danno polmonare indotto da bleomicina attenuando SASP e risposte alle lesioni.
Data l’eterogeneità e la complessità dei processi di invecchiamento, lo sviluppo di interventi anti-invecchiamento dovrà considerare gli aspetti di specificità, efficacia e sicurezza per avanzare verso lo sviluppo clinico. Il profarmaco SSK1 sviluppato da Cai et al. dimostra proprietà funzionali che sembrano offrire alcuni vantaggi rispetto ad altri senolitici riportati. In particolare, ABT-263 elimina i fibroblasti senescenti (fibroblasti embrionali umani (HEF)) e le cellule endoteliali (cellule endoteliali della vena ombelicale umana (HUVEC)), ma mostra scarso effetto sui preadipociti umani, mentre la combinazione Dasatinib/Quercetina sembra uccidere tutti questi tre tipi di cellule senescenti ma anche alcune cellule non senescenti. D’altra parte, la fisetina mostra un effetto modesto sugli HEF senescenti e sui preadipociti a dosi elevate (dimostrato da Cai et al. e studi precedenti).
Al contrario, SSK1 supera queste limitazioni eliminando efficacemente le cellule senescenti indipendenti dai tipi cellulari, specie e stimoli e riducendo la tossicità per le cellule non senescenti. In modo incoraggiante, gli autori mostrano anche che l’alta concentrazione e l’alta frequenza del trattamento con SSK1 non causano tossicità sistemiche apparenti nei topi anziani, risultati che fanno ben sperare per la sicurezza in vivo in contesti più ampi.
Sebbene SSK1 dimostri vantaggi promettenti rispetto ad altri senolitici, rimangono sfide da considerare per lo sviluppo clinico. In primo luogo, la senescenza in sé e per sé fornisce benefici fisiologici al corpo durante lo sviluppo, la guarigione delle ferite, la rigenerazione e la resistenza alla tumorigenesi. Pertanto, è necessario studiare i potenziali effetti collaterali fisiologici di SSK1, così come altri senolitici. In secondo luogo, i senolitici come classe sono stati studiati in modo completo in una serie di modelli preclinici di malattia e invecchiamento (tra cui malattie cardiovascolari, fibrosi polmonare idiopatica, disturbi della neurodegenerazione, diabete, mobilità indotta da stress e fragilità), con Dasatinib/Quercetina in corso in studi preclinici ( fase I nella malattia renale diabetica e nel morbo di Alzheimer) e fisetina già in studi clinici (fase IIb per ridurre i fenotipi senescenti nelle donne anziane). Relativamente a questi entusiasmanti progressi, gli effetti in vivo di SSK1 in tali contesti sono attualmente sconosciuti. In terzo luogo, vi è una generale mancanza di conoscenza su come i senolitici, incluso l’SSK1, influiscano sull’invecchiamento nei mammiferi di ordine superiore la cui durata della vita è più vicina a quella degli esseri umani.
In conclusione, prendendo di mira un biomarcatore di senescenza, il nuovo profarmaco sviluppato da Cai et al. ottiene con successo l’eliminazione selettiva delle cellule senescenti in un’ampia gamma di tipi cellulari. Questi risultati sono in linea con il lavoro precedente che ha dimostrato il potenziale dei senolitici come classe per estendere la durata della vita e la durata della salute nei modelli sperimentali di malattia. Gli sforzi futuri incentrati sulla sicurezza e l’efficacia di SSK1 in modelli in vivo più clinicamente rilevanti aiuteranno a informare la fattibilità della terapia SSK1 nell’invecchiamento umano. Tenendo conto della complessità dell’invecchiamento umano, è possibile che per migliorare la salute degli anziani possano essere necessari regimi che combinano i senolitici con interventi mirati ad altri processi fondamentali.