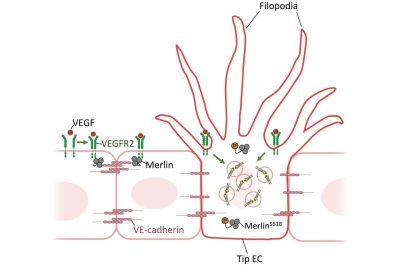
(Angiogenesi-Immagine:Figura 1. La proteina merlin endoteliale svolge un ruolo di gatekeeper nell’induzione della punta EC mediata dal blocco dell’internalizzazione del VEGFR2 ad alta densità di VE-caderina. Diagramma schematico raffigurante i ruoli di Merlin in diverse densità di VE-caderina in ciascuna EC. Merlin attiva forma un complesso con VEGFR2 e VE-caderina a densità di VE-caderina relativamente alta, mentre Merlin inattivo (S518) consente un’elevata interiorizzazione del VEGFR2 negli EC con bassa densità di VE-caderina, che porta all’induzione dell’EC di punta. Credito: Science Advances (2022). DOI: 10.1126/sciadv.abn2611).
I vasi sanguigni sono l’architettura essenziale del corpo che esiste per nutrire le cellule con nutrienti e ossigeno sufficienti. L’angiogenesi o la formazione di nuovi vasi sanguigni, è di grande interesse per la ricerca sul cancro. Poiché i tumori devono generare nuovi vasi sanguigni per crescere, l’inibizione dell’angiogenesi è stata suggerita come un approccio promettente per il trattamento del cancro.
L’angiogenesi è il processo in cui si formano nuovi germogli da vasi preesistenti. Il processo biologico chiave nell’angiogenesi coinvolge il bilanciamento della formazione di cellule endoteliali (EC) “punta” e “gambo”. Questo è un processo chiamato tip-stalk. Le cellule EC di punta sono altamente mobili con molti filopodi lunghi e dinamici, mentre le EC di stelo sono altamente proliferative con un minor numero di filopodi. Queste cellule della punta e del gambo funzionalmente distinte si coordinano in una rete ramificata di vasi per la germinazione dell’angiogenesi.
Morfologicamente, l’induzione delle EC di punta è il passaggio più importante per l’angiogenesi germogliante. La formazione delle EC di punta è indotta da una via di segnale chiamata fattore di crescita endoteliale vascolare (VEGF)-A (indicato come VEGF). Molecolarmente, l’attivazione intracellulare della via di segnale VEGFR2 è avviata dall’internalizzazione di VEGFR2 indotta dal ligando, clatrina-dipendente. Gli scienziati sono stati a lungo curiosi di sapere come una particolare EC finisca per possedere un’attività di segnalazione VEGFR2 più elevata rispetto ai suoi vicini ed è quindi destinata a diventare una punta EC durante l’angiogenesi germogliante.
Guidati dalla Dott.ssa Bae Jung Hyun e dal Professor Koh Gou Young, i ricercatori del Center for Vascular Research all’interno dell’Institute for Basic Science (IBS) di Daejeon, in Corea del Sud, hanno scoperto che una proteina chiamata Merlin (la neurofibromina 2, anche chiamata merlina o schwannomina è una proteina del citoscheletro. Negli esseri umani è codificata da un gene oncosoppressore coinvolto nella patogenesi della neurofibromatosi di tipo 2), è indispensabile per l’induzione della tip EC regolando la segnalazione VEGFR2 intracellulare a valle durante l’angiogenesi germogliante.
La proteina merlin, codificata dal gene della neurofibromatosi di tipo 2 NF2, è nota da molto tempo per funzionare come soppressore del tumore. È espressa in modo ubiquo in tutti i tipi di cellule e agisce come una proteina associata alla membrana, che svolge un ruolo di gatekeeper nella trasduzione del segnale dai recettori di membrana in modo dipendente dalla densità cellulare. Tuttavia, non è stato studiato se Merlin endoteliale sia essenziale nella germinazione dell’angiogenesi e, in dettaglio, quale segnalazione intracellulare sia regolata da Merlin endoteliale.
Nel loro studio pubblicato su Science Advances, i ricercatori hanno dimostrato che la densità della EC nell’ambiente era il fattore chiave. Quando sono state confrontate la localizzazione e la densità di Merlin nelle cellule a bassa o alta densità di coltura, Merlin nella coltura ad alta densità cellulare è stata in grado di formare meglio il complesso con VEGFR2. I ricercatori hanno dimostrato che ciò è dovuto al fatto che la presenza di VE-caderina, una proteina di giunzione cellula-cellula, è necessaria affinché Merlin e VEGFR2 formino un complesso l’uno con l’altro. Questa formazione del complesso Merlin-VEGFR2 sopprime l’interiorizzazione del VEGFR2, sopprimendo così il percorso. Al contrario, Merlin in un ambiente EC a bassa densità con densità VE-caderina relativamente bassa consente un alto livello di segnalazione VEGFR2 e attivazione di ERK, che porta all’induzione di tip EC (Fig.1).
I ricercatori hanno studiato l’importanza della densità cellulare sulla formazione del complesso Merlin-VEGFR2 studiando Merlin nella sua forma normale, forma fosforilata inattiva e una variante che non può essere fosforilata. È stato dimostrato che Merlin si impegna nell’interazione fisica con VEGFR2 e VE-caderina in coltura densa, che ha un basso pMerlin (S518), ma Merlin non si impegna in questa interazione in coltura sparsa, con un alto pMerlin (S518) in EC coltivate. Pertanto, l’interazione tra Merlin e VEGFR2 dipende da pMerlin (S518), che è regolato dalla densità cellulare.
“Il ruolo di Merlin in EC soddisfa il tassello mancante per l’angiogenesi germogliante. L’angiogenesi germogliante dovrebbe essere regolata dall’equilibrio coordinato di promozione e inibizione della segnalazione attraverso Merlin”, spiega il primo autore dello studio, Bae Jung Hyun.
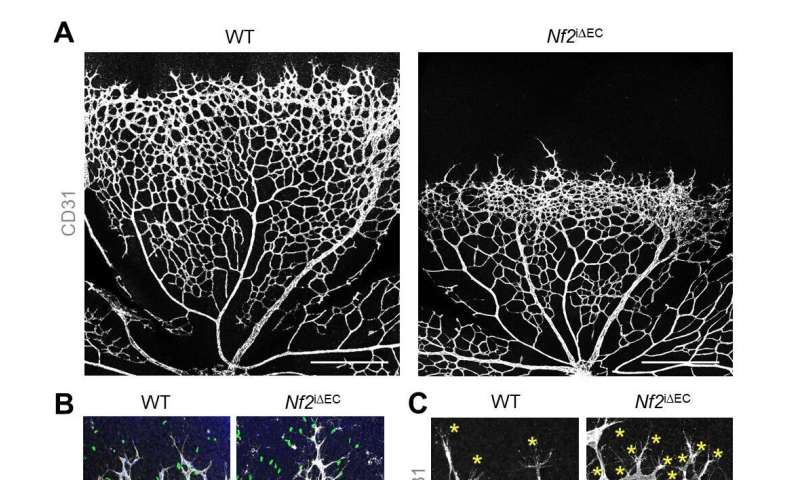
I ricercatori hanno inoltre dimostrato che Merlin svolge anche un ruolo di gatekeeper nel mantenimento dell’integrità capillare e della corretta angiogenesi sopprimendo la formazione non necessaria di filopodia e germogliando dai vasi adulti nei tessuti e nei tumori normali. Quando il Merlin è stata esaurita nella cellule endoteliali EC, i ricercatori hanno scoperto che nel modello tumorale si forma una quantità eccessiva di vasi non funzionali, che migliora la necrosi tumorale e riduce la crescita del tumore. I topi carenti di Merlin impiantati con cancro del polmone umano hanno mostrato un’impressionante riduzione dell’80,6% della crescita del tumore dopo 3 settimane rispetto ai topi normali. Allo stesso modo, i vasi adulti nella ghiandola tiroidea e nell’intestino tenue hanno mostrato un aumento del numero di filopodi nei topi privati di Merlin rispetto ai topi wild-type.
Il Direttore Koh Gou Young del Center for Vascular Research ha riassunto: “Il nostro studio ha dimostrato che Merlin è principalmente localizzata sulla membrana cellulare nelle EC vascolari, interagisce con VEGFR2 e VE-caderina e svolge un ruolo negativo nella segnalazione intracellulare del VEGFR2 sopprimendo VEGFR2. Di conseguenza, Merlin endoteliale può essere vista come un regolatore di gatekeeper per l’induzione della EC della punta nell’angiogenesi retinica durante lo sviluppo postnatale, per le formazioni di filopodia e germogli negli EC capillari maturati e stabiliti degli adulti e per la formazione delle cellule della punta”.
Fonte: Science Advances