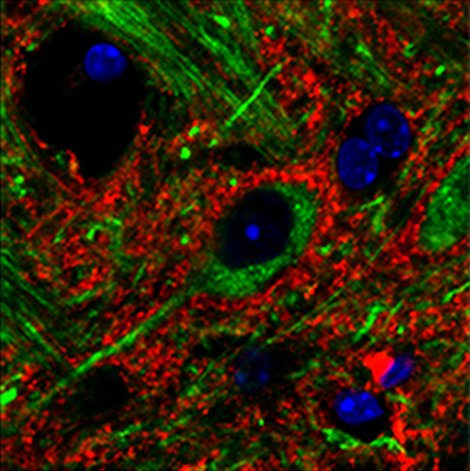
Immagine: immagine microscopio confocale mostra abbondanti proteine C1qa (rosso) che circondano i neuroni del talamo ventrale (verde) in topi privi di progranulin.Immagine di Huang Lab
La demenza frontotemporale (FTD), la seconda causa più comune di demenza nelle persone sotto i 65 anni, può essere innescata da un difetto nelle cellule immunitarie chiamate microglia che le induce a consumare connessioni sinaptiche del cervello, secondo una nuova ricerca condotta da scienziati della University of California, San Francisco (UCSF).
Il nuovo studio – pubblicato il 21 aprile 2016 sulla rivista Cell, si aggiunge alla crescente evidenza secondo cui il sistema immunitario del cervello è una forza trainante dietro molte malattie neurodegenerative e suggerisce nuovi approcci per la diagnosi e il trattamento di pazienti affetti da FTD, che colpisce attualmente 22 su 100.000 adulti, con la tipica insorgenza in età compresa tra 45 e 65 anni.
La microglia normalmente agisce come spazzino del cervello, occupandosi dello smaltimento di particelle estranee come virus o batteri e cellule cerebrali malate e morenti. Nel cervello in via di sviluppo, la microglia può aiutare a perfezionare i circuiti del cervello con la “potatura” di connessioni neurali non necessarie o intervenire nella distruzione di molecole immunitarie chiamate ” proteine di complemento”.
(Il sistema del complemento, insieme con gli anticorpi, è un elemento essenziale del sistema immunitario nei meccanismi di difesa umorale contro gli agenti infettivi. Esso è costituito da una trentina di proteine circolanti e di membrana, capaci di interagire reciprocamente e con le membrane cellulari. L’attivazione a cascata delle sue proteine solubili, che convenzionalmente vengono chiamate componenti, è alla base di attività biologiche varie come la lisi cellulare, batterica o virale; queste componenti si introducono nelle membrane degli agenti patogeni provocando su di esse pori che portano alla lisi. Durante l’attivazione del complemento si ha inoltre il reclutamento di varie cellule immunocompetenti, come cellule fagocitarie (monociti, macrofagi, polinucleati), linfociti B e linfociti T).
Recenti studi condotti dal neurobiologo Beth Stevens, PhD e colleghi hanno suggerito che questo processo può “andare storto” durante l’adolescenza in pazienti con schizofrenia o come effetto collaterale dell’ invecchiamento nei pazienti con malattia di Alzheimer: in entrambi i casi un eccesso di proteine di complemento sembra causare troppe sinapsi contrassegnate per la distruzione da parte della microglia.
” il sistema immunitario innato del cervello sta emergendo come un percorso comune alla base di molte malattie neurodegenerative”, ha detto l’autore senior dello studio Eric Huang, MD, PhD, Professore di patologia alla UCSF e patologo UCSF-affiliated San Francisco VA Medical Center. “Questa idea è controversa, ma nei pazienti umani, la neurodegenerazione è in genere accompagnata da un certo grado di infiammazione, con molta microglia attivata. E’ difficile dire se essa è un driver della degenerazione o una conseguenza “.
Lavorando con i colleghi UCSF’s Memory and Aging Center e del dipartimento di Neurology and Neurological Surgery, così come con UCSF-affiliated Gladstone Institutes e Stanford University, Huang e il suo team hanno analizzato il tessuto cerebrale da pazienti FTD umani con mutazioni familiari nella progranulina genica e topi con questo gene inattivato. Nei topi, il difetto ha causato neurodegenerazione legata all’età, mentre sintomi del disturbo ossessivo-compulsivo (OCD) sono stati osservati nei pazienti FTD umani.
(Una percentuale significativa di pazienti con FTD riporta nel proprio albero genealogico altri famigliari affetti da un disturbo neurologico o psichiatrico evoluto in demenza
Recentemente, lo studio di famiglie FTD negative per la presenza di mutazioni nel gene MAPT (FTD TAU-negativa) ha portato all’identifificazione di un nuovo gene implicato nell’insorgenza di FTD: gene Progranulina. La proteina Progranulina è un fattore di crescita coinvolto nella regolazione di numerosi processi (sviluppo, riparo di lesioni, infiammazione, tumorigenesi) ed è espressa in differenti tipi cellulari tra cui i neuroni. Il suo ruolo a livello cerebrale non è del tutto chiarito, ma è noto il suo coinvolgimento nello sviluppo del sistema nervoso centrale. Numerose mutazioni a livello del gene PGRN sono documentate associate a FTD che sembra essere causata da una riduzione della quota di proteina funzionale (aploinsufficienza) piuttosto che dall’espressione di una proteina mutata).
I ricercatori hanno scoperto che nei topi anziani, la mutazione ha causato un graduale ripartizione dei ‘sistemi di smaltimento dei rifiuti’, che hanno portato alla eccessiva attivazione delle cellule microgliali con funzioni immunitarie aggressive, la produzione elevata di proteine del complemento ed eccessiva potatura sinaptica nel talamo, una parte del cervello che è molto importante per FTD umana.
Ulteriori esperimenti sulla microglia hanno messo in evidenza che progranulin agisce normalmente come un freno per impedire l’attivazione eccessiva della microglia. Senza di essa, è emerso un aspetto sconosciuto del normale processo di invecchiamento che ha permesso alla microglia di andare fuori controllo.
Tuttavia, i ricercatori hanno dimostrato che i topi con progranulina e i geni C1qa inattivi (questo gene codifica per una componente importante del complemento sottocomponente umana C1q), sono vissuti molto più a lungo rispetto a quelli con C1qa attivo e non hanno sviluppato comportamenti OCD-like. I loro cervelli hanno anche mostrato una drastica riduzione del numero di microglia attivata e migliore protezione da perdita sinapsi.
“Abbiamo lavorato per più di due anni per arrivare a questo risultato”, ha detto Huang, “ma quando abbiamo fatto, è stata un’esperienza davvero surreale. E’ stato subito chiaro che il blocco di proteine del complemento potrebbe essere un buon obiettivo terapeutico per i pazienti FTD con mutazioni progranulina“.
Nuovi approcci per la demenza frontotemporale
Huang e il suo team stanno ora collaborando con una società di biotecnologia chiamata Annexon per testare terapie che bloccano C1qa. Tuttavia, questi trattamenti sono probabilmente ancora molto lontani. Per prima cosa, i trattamenti per la neurodegenerazione devono essere assunti precocemente, prima che il danno cerebrale sia prodotto e non c’è ancora modo di rilevare in modo affidabile la malattia prima che sia troppo tardi.
Ecco perché i ricercatori hanno anche esaminato se gli elevati livelli di proteine del complemento appaiono nel liquido cerebrospinale dei pazienti (CSF). Se così fosse, potrebbero potenzialmente servire come biomarker per consentire la diagnosi precoce della malattia.
Inizialmente i ricercatori sono stati delusi dai risultati: “Abbiamo esaminato CSF nei cervelli normali e malati e questi livelli sembravano uguali”, ha detto Huang. “Ma poi abbiamo provato a dividere i pazienti FTD sulla base del grado di gravità della loro demenza e il risultato è stato davvero spettacolare. Chiaramente, come lo stato di salute mentale dei pazienti è diminuito, il livello di proteine del complemento è aumentato”.
Huang spera che la ricerca futura possa permettere ai medici di utilizzare questo segnale per consentire una diagnosi precoce e per testare l’efficacia di potenziali trattamenti.
Fonte: University of California