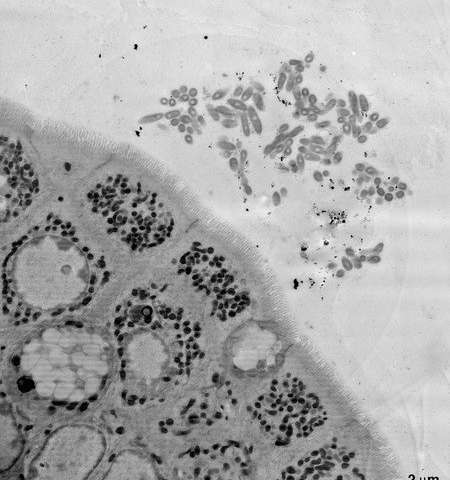
Immagine: un’immagine al microscopio elettronico di una sezione dell’intestino del topo, che mostra B. fragilis aggregante vicino alle cellule epiteliali che compongono il rivestimento dell’intestino. Credito: laboratorio Mazmaniano.
Il microbioma intestinale utilizza l’immunoglobulina A per la colonizzazione della mucosa intestinale, secondo un nuovo studio.
L’intestino dei mammiferi è caldo, umido e incredibilmente ricco di sostanze nutritive, un ambiente perfetto per la crescita batterica. Le comunità di “batteri buoni” nell’intestino, comunemente definiti microbioma, sono partner vitali del corpo, aiutano a digerire le fibre, a estrarre sostanze nutritive e a prevenire varie malattie. Conosciamo tutti le risposte immunitarie e le malattie che derivano da batteri cattivi o patogeni che entrano nel corpo, quindi, se il sistema immunitario si è evoluto per respingere i microbi, allora come fanno i mammiferi a mantenere relazioni armoniose con i batteri benefici nell’intestino?
Ora, una nuova ricerca di Caltech illustra come una particolare specie di batteri benefici imbrigli effettivamente la risposta immunitaria del corpo in modo che possa stabilirsi comodamente nell’intestino.
Il lavoro è stato svolto nel laboratorio di Sarkis Mazmanian, Luis B. e Nelly Soux, Professore di microbiologia e ricercatore dell’ Heritage Medical Research Institute. Un articolo che descrive la ricerca è stato pubblicato online il 3 maggio sulla rivista Science.
Guidati dal Dr. Gregory Donaldson, i ricercatori del laboratorio di Mazmanian hanno scelto di esaminare un microbo chiamato Bacterioides fragilis. Questa particolare specie si trova abbondantemente nell’intestino crasso di molti mammiferi, compreso l’uomo, ed è stato precedentemente dimostrato dal laboratorio di Mazman che protegge i topi da alcuni disturbi infiammatori e neurologici come la malattia infiammatoria intestinale e la sclerosi multipla. È interessante notare che, sebbene ci siano più ceppi di B. fragilis, le persone sane formano una relazione monogama a lungo termine con un solo ceppo.
“Studi condotti da altri laboratori hanno dimostrato che la maggior parte delle persone porta lo stesso ceppo di B. fragilis per tutta la vita”, afferma Donaldson. “Volevamo capire a livello molecolare come questi batteri sono in grado di colonizzare l’intestino in modo stabile, a lungo termine”.
In primo luogo, i ricercatori hanno cercato di esaminare la relazione simbiotica di B. fragilis con l’intestino osservando fisicamente le posizioni in cui i batteri risiedono. Usando l’imaging al microscopio elettronico su campioni di intestino di topo, il team è stato in grado di vedere che B. si frammenta in aggregati in profondità nello spesso strato di muco che riveste l’intestino, situato vicino alle cellule epiteliali che rivestono la superficie dell’intestino. Donaldson ed i suoi collaboratori hanno teorizzato che questa nicchia spaziale è necessaria affinché una singola specie si insedi e stabilisca in un punto d’appoggio stabile.
( Vedi anche:Lo stress psicologico porta a cambiamenti nel microbioma intestinale).
Il team ha poi puntato a determinare quali meccanismi permettessero a B. fragilis di colonizzare una tale nicchia nell’intestino. I ricercatori hanno scoperto che ogni B. fragilisbacterium è racchiuso in una capsula densa fatta di carboidrati. La capsula è tipicamente associata a patogeni (batteri cattivi) che tentano di nascondersi dal riconoscimento e dall’attacco del sistema immunitario del corpo. I batteri mutanti privi di questa capsula non possono aggregarsi e non abitano nello strato mucoso. Quindi, i ricercatori hanno teorizzato che i carboidrati capsulari sono necessari per B. fragilis per monopolizzare la loro nicchia nell’intestino.
Poiché le capsule batteriche erano note per essere correlate a una risposta immunitaria in batteri patogeni, Donaldson e Mazmanian hanno ipotizzato che potesse esserci anche una risposta immunitaria alla capsula di B. fragilis. Infatti, hanno scoperto che anticorpi, proteine immunitarie che afferrano e contrassegnano specifici batteri o virus per altre cellule immunitarie da inghiottire e distruggere, erano vincolanti per la capsula B. fragilis nell’intestino. Un particolare tipo di anticorpo, immunoglobulina A o IgA, è presente in tutto l’intestino, infatti è il tipo di anticorpo più abbondantemente prodotto negli esseri umani, ma le sue funzioni specifiche sono ancora enigmatiche.
Normalmente, una risposta anticorpale significa morte imminente per batteri patogeni. Ma curiosamente, l’IgA non influisce negativamente sulla maggior parte dei batteri che normalmente vivono nell’intestino. Nel caso di B. fragilis, i ricercatori hanno scoperto che in realtà l’IgA ha aiutato i batteri a rimanere attaccati alle cellule epiteliali. Inoltre, nei topi privi di IgA, il batterio ha avuto meno successo nel colonizzare la superficie dell’intestino e nel mantenere la stabilità a lungo termine.
Il team ritiene che questa risposta di IgA alla capsula di B. fragilis aiuti ad ancorare i batteri alla superficie epiteliale, fornendo così un vantaggio.
“È sorprendente scoprire che una risposta immunitaria aiuta effettivamente i batteri benefici a prosperare, il che a sua volta aiuta l’ospite a prosperare”, afferma Donaldson. “Lo studio dell’immunologia è stato principalmente nel contesto di batteri patogeni, ma ci sono migliaia di miliardi di batteri nell’intestino e il più delle volte nessuno di loro ti sta facendo star male. Il nostro studio mostra che esiste un riconoscimento immunitario attivo di questi batteri che li aiuta piuttosto che ostacolarli, il che suggerisce che il sistema immunitario è più di un semplice sistema di difesa e che gli anticorpi non sono solo delle armi”.
Nel lavoro futuro, i ricercatori hanno in programma di studiare come nasce la risposta anticorpale dell’intestino e perché aiuta B. fragilis mentre altri anticorpi combattono i batteri. In definitiva, questo lavoro potrebbe essere utilizzato per migliorare la colonizzazione da altri batteri benefici, ad esempio attraverso l’uso di probiotici.
“Negli ultimi dieci anni, molti studi hanno profilato il microbioma intestinale in una varietà di malattie, stili di vita, geografie e successiva nascita“, afferma Mazmanian. “Abbiamo appreso che la composizione della comunità del microbioma si correla con condizioni particolari – per esempio, le configurazioni alterate del microbioma possono contribuire alla malattia infiammatoria intestinale, all’autismo e alla malattia di Parkinson. Quello che è rimasto in gran parte sconosciuto è come viene stabilito e mantenuto un microbioma: il nostro studio rivela un meccanismo molecolare mediante il quale specifici batteri benefici promuovono attivamente la colonizzazione intestinale a lungo termine coinvolgendo e cooptando il sistema immunitario, piuttosto che cercare di eluderlo come fanno gli agenti patogeni. Questa scoperta potrebbe portare a nuovi modi per correggere gli squilibri dei microbiomi e forse prevenire e trattare una varietà di disturbi umani”.
Fonte: Science