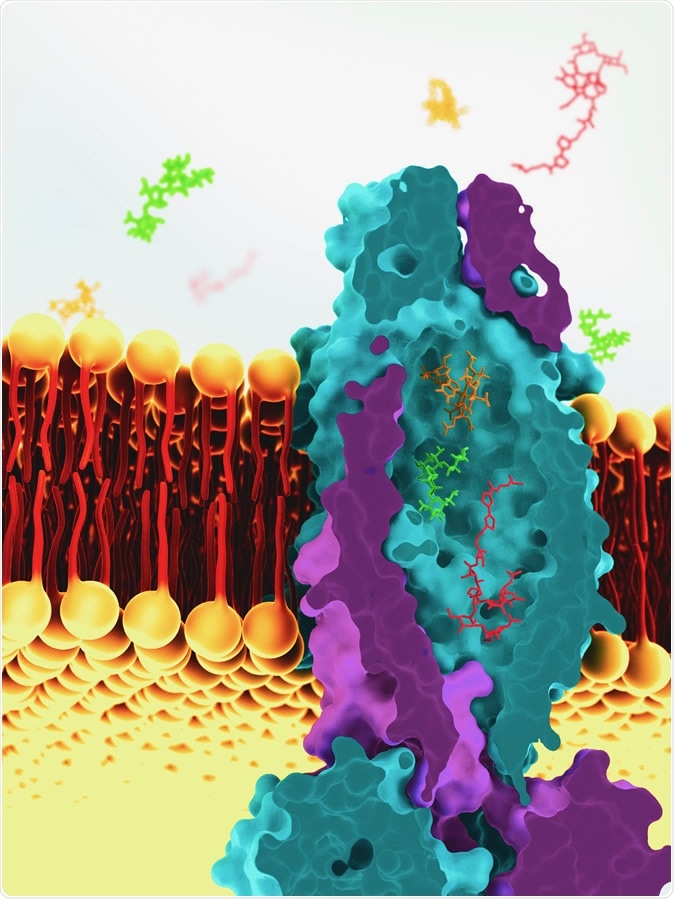
Immagine: questa è una ricostruzione del trasportatore di vitamina B12 da Mycobacterium tuberculosis, basata su immagini di cryoEM. La molecola di trasporto aiuta a trasportare le molecole nella cellula. Immagine di credito: Greg Stewart / SLAC National Accelerator Laboratory
Un nuovo studio pubblicato sulla rivista Nature nel marzo 2020 riporta la scoperta di una proteina di trasporto unica trovata all’interno del bacillo tubercolare, Mycobacterium tuberculosis. Questa enorme proteina vescicolare che si estende sulla membrana è diversa dalle altre proteine di trasporto ed è fondamentale per trasportare molecole idrofile, in particolare vitamina B12 o cobalamina, attraverso la membrana cellulare.
Lo studio si è basato sull’uso della microscopia crioelettronica per acquisire immagini della proteina di trasporto. Il batterio della tubercolosi è un organismo completo in quanto ha tutti i macchinari genetici necessari per produrre cobalamina nelle sue cellule. Tuttavia, deve importare la vitamina dall’esterno per una divisione cellulare di successo.
Trasportatori ABC
Per realizzare questo processo, il batterio utilizza una proteina trasportatrice della vitamina B12, una di una grande famiglia di proteine di trasporto (ABC) ATP-binding. Queste proteine fanno uso dell’energia chimica immagazzinata nelle molecole di ATP per trasportare le molecole del substrato attraverso la membrana cellulare. Questi trasportatori sono anche coinvolti nel trasporto di peptidi come la bleomicina, che inibisce la crescita microbica. “Questa è una stranezza”, secondo il ricercatore Dirk Slotboom, che afferma che due molecole molto diverse sono raramente trasportate dallo stesso trasportatore. Questa particolarità ha favorito l’attuale studio per esaminare la struttura di questa proteina unica. Slotboom afferma: “‘È stato un processo lungo, ma alla fine l’abbiamo risolto utilizzando la microscopia crioelettronica e i risultati sono stati sorprendenti: la proteina conteneva ciò che può essere descritto solo come massiccio, una grande cavità riempita con acqua che si estende su tutta la larghezza della membrana cellulare, con una capacità di 7.700 cubi di Angstrom, fino a sette molecole di cobalamina, secondo il ricercatore. (L’ångström (Å), o angstrom è un’unità di lunghezza non appartenente al Sistema internazionale (SI) corrispondente a 0,1 nm o 1×10−10 m– Questa unità di misura viene spesso impiegata per indicare le dimensioni delle molecole e degli atomi).
Come funziona
Il funzionamento del trasportatore sembra essere di estrema semplicità: svuotarsi, con tutto ciò che è nell’acqua. Slotboom continua spiegando: “Ha lasciato entrare l’acqua e tutto ciò che è in essa”. Questo è probabilmente il modo in cui può trasportare sia la vitamina che il peptide antibiotico, nonostante le loro strutture molto diverse. La capacità di trasporto non selettiva ha anche i suoi svantaggi, il più ovvio dei quali è che è abbastanza inefficiente. Tuttavia, questo non è un problema in questa situazione, in cui il bacillo deve assumere solo un numero limitato di molecole di cobalamina per completare il suo ciclo riproduttivo della durata di circa 24 ore.
Vedi anche: Tubercolosi: come una mutazione ha causato l’antibiotico-resistenza
Una proteina di trasporto unica
I ricercatori sono sorpresi della differenza tra questo trasportatore e qualsiasi altra proteina di trasporto convenzionale nota. Commentano: “Questa proteina cambia il modo in cui guardiamo alla fisiologia dei batteri. Ci sono forti indicazioni che altre specie batteriche hanno un sistema simile, il che significa che raccolgono molecole casuali dal loro ambiente”.
I ricercatori sono incuriositi dalla possibilità che le cellule umane possano anche avere un meccanismo molto simile per trasportare sostanze come la cobalamina. Questa vitamina si lega prima a un peptide gastrico chiamato fattore intrinseco. Questo peptide, dalle cellule parietali gastriche specializzate del rivestimento dello stomaco, consente alla vitamina B12 di formare un complesso con esso. Questo complesso viene quindi ripreso dalle cellule epiteliali. Il complesso infine finisce nei lisosomi all’interno delle cellule epiteliali. I lisosomi sono “sacche suicide” piene di potenti enzimi. Qui, il fattore intrinseco viene scomposto e la vitamina B12 viene rilasciata dal lisosoma perchè possa entrare nelle cellule. Qui prende finalmente parte al metabolismo della cellula. Slotboom dice “Sospetto fortemente che ciò implichi un trasportatore non specifico simile”.
Gli scienziati pensano anche che potrebbero essere in grado di stimolare l’attività della proteina di trasporto della cobalamina-bleomicina per aiutare a curare la tubercolosi. Dicono: “‘Se potessimo stimolare l’attività di questo trasportatore, potrebbe importare antibiotici in modo più efficiente, rendendo più facile uccidere il batterio. Ci rendiamo conto, tuttavia, che questo potrebbe non essere semplice, poiché il batterio utilizza strategie efficaci per mantenere fuori gli antibiotici “.
A tal fine, gli scienziati stanno analizzando il funzionamento del trasportatore. L’ipotesi attuale è che “All’interno della cellula, la proteina si svuota legando e idrolizzando l’ATP. Ma non sappiamo come si apre all’esterno, per far entrare nuove molecole”.
Il trasportatore dimero è composto da due metà. Queste sembrano proiettarsi all’esterno della membrana cellulare ed è possibile che si aprano in qualche modo, come un cancello, per consentire al carico fresco di entrare nella cellula. Gli scienziati vogliono vedere se possono in qualche modo stimolare questo processo di apertura o allentamento in modo da aumentare l’ingresso di antibiotici.
Fonte: NewsMedical