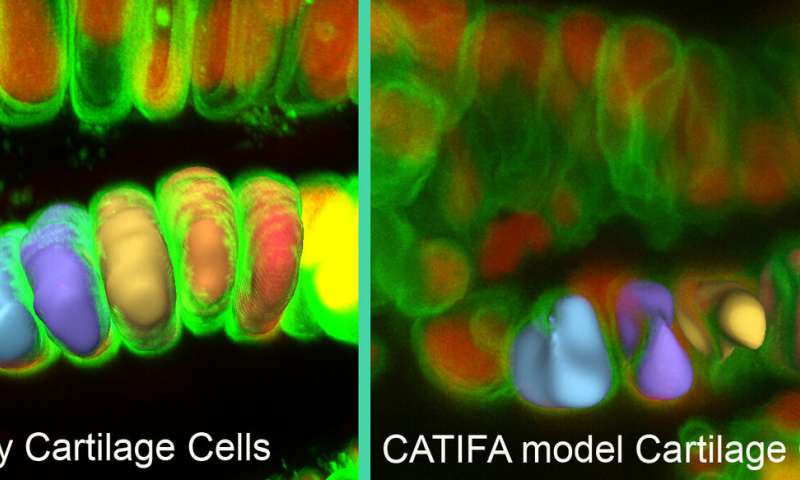
Gli studi iniziati sul pesce zebra hanno ora indicato il ruolo della secrezione di collagene in un’ampia varietà di sintomi clinici e in una sindrome genetica recentemente identificata.
Ela Knapik, MD, Professore associato di Medicina presso il Vanderbilt University Medical Center ed i suoi colleghi, hanno scoperto una sindrome causata dalla mutazione di un singolo gene che hanno chiamato CATIFA, un acronimo dei suoi sintomi principali: palatoschisi, cataratta, anomalia dei denti, disabilità intellettiva , dismorfismi facciali e ADHD.
Lo studio, riportato il 13 gennaio in Nature Medicine, ha combinato tre fonti di informazioni: un modello di pesce zebra, una malattia genetica pediatrica e un database di cartelle cliniche elettroniche collegate a una biobanca del DNA. “Ognuna di queste tre fonti di dati ha i suoi vantaggi e le sue carenze per la scoperta di malattie“, ha affermato Knapik, Professore associato di Biologia cellulare e dello sviluppo presso la Vanderbilt University. “Ho pensato di usarle contemporaneamente”, ha detto il ricercatore.
Knapik e il suo team stavano esplorando la funzione di un gene chiamato RIC1 nel pesce zebra. Sapevano che la mutazione di RIC1 interrompeva la secrezione di collagene e causava difetti craniofacciali e altri difetti dello scheletro, nei pesci. Hanno appreso che un altro gruppo di ricercatori aveva riportato una mutazione nel gene RIC1 (la versione umana del gene RIC1 zebrafish) in più bambini di una singola famiglia con cataratta pediatrica. Il team di Knapik ha valutato il pesce zebra per la cataratta, ma non ha trovato la mutazione.
La ricerca avrebbe potuto finire lì, ma Knapik era incuriosito. I bambini avevano altri sintomi che non erano stati caratterizzati perché il loro problema più urgente era la cataratta? Quali potevano essere questi sintomi? Per scoprire ulteriori sintomi, Knapik e i suoi colleghi del Vanderbilt Genetics Institute si sono rivolti a BioVU, la biobanca del DNA di Vanderbilt e al database delle cartelle cliniche elettroniche non identificate.
Eric Gamazon, Ph.D., istruttore di ricerca specializzato in Medicina e Nancy Cox, Ph.D., Mary Phillips Edmonds Gray, Professore di genetica e Direttore del Vanderbilt Genetics Institute, avevano precedentemente sviluppato un metodo computazionale, chiamato PrediXcan, per correlare geneticamente espressione genica regolata con le caratteristiche cliniche incluse nella cartella clinica elettronica. Quando applicato a BioVU, il metodo genera un elenco di caratteristiche cliniche legate alla ridotta espressione di un gene specifico.
L’elenco che hanno generato per la riduzione dell’espressione RIC1 corrispondeva alle caratteristiche che Knapik e il suo team hanno osservato nel pesce. Ha detto Knapik: “In quel momento sapevo che avevamo bisogno di maggiori informazioni sui pazienti con mutazione RIC1 e cataratta pediatrica”.
Il team in Arabia Saudita che aveva segnalato i pazienti con mutazione RIC1 ha accettato di rivalutare quei pazienti per l’elenco dei sintomi derivati dalla BioVU. Knapik ha rivelato che i ricercatori sono stati sorpresi di trovare la costellazione dei sintomi individuati con il metodo computazionale, nei loro pazienti: otto bambini di due famiglie correlate.
“I sintomi della nuova malattia, CATIFA, possono essere spiegati dalla perdita della funzione del collagene”, ha affermato Knapik. “Il collagene è il principale componente strutturale della matrice extracellulare: la “malta” tra i “mattoni” cellulari”.
Usando il pesce zebra, Knapik e il suo team sono stati in grado di determinare che la proteina RIC1 fa parte del meccanismo cellulare che elabora e trasporta il collagene fuori dalla cellula.
“In assenza di RIC1, non ottieni il trasporto del collagene e non hai una matrice“, ha spiegato Knapik. “Ciò porta all’ampio spettro di sintomi che troviamo nelle cartelle cliniche elettroniche degli adulti e dei bambini con CATIFA”.
“I risultati di questo studio supportano il concetto di un continuum tra i singoli sintomi in una rara malattia di Mendel – una malattia causata dalla mutazione di un singolo gene – e i tratti complessi delle malattie comuni. Conoscere il fondamento meccanicistico della malattia e i sintomi che possono sorgere, migliorerà e personalizzerà l’assistenza per i bambini con CATIFA e per gli adulti con sintomi simili causati da un’attività meno efficiente di RIC1″, ha aggiunto Knapik.
“Lo studio suggerisce un nuovo paradigma per accelerare il processo di scoperta dei meccanismi delle malattie”, ha affermato Knapik.
“Con la conoscenza proveniente da modelli animali, biobanche di malattie comuni umane e rare malattie mendeliane, possiamo mettere insieme un quadro completo della funzione genica e avanzare verso una migliore diagnosi, trattamento e prevenzione”, ha concluso il ricercatore.
Fonte, Nature