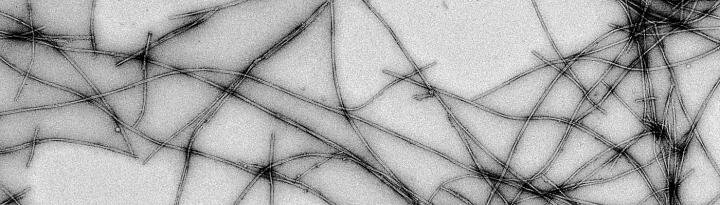
Immagini, filamenti di alfa-sinucleina maturi. Credito: Guilherme A. P. de Oliveira.
Una delle maggiori difficoltà nel trattamento del morbo di Parkinson, un disturbo neurodegenerativo progressivo, è la comprensione di quando inizia.
Ora, uno studio pubblicato su Communications Biology da ricercatori dell’Università Federale di Rio de Janeiro, in Brasile, e della University of Virginia School of Medicine, USA, può aiutare a chiarire questo enigma. Per la prima volta, gli scienziati hanno osservato come le varianti della proteina alfa-sinucleina associata al morbo di Parkinson cambiano nel tempo e sono stati in grado di identificare le fasi iniziali degli aggregati proteici collegati all’insorgenza precoce dei casi familiari della malattia.
“Una persona sviluppa il morbo di Parkinson nel corso della sua vita. La conversione da uno stadio proteico all’altro avviene lentamente. Le strutture intermedie e gli aggregati amiloidi si accumulano nel tempo nel cervello. Finora non sappiamo quali specie causino i sintomi e tossicità per le cellule “, afferma l’autore principale della ricerca Guilherme AP de Oliveira, ricercatore presso l’Università della Virginia e Professore presso l’UFRJ. “Se comprendiamo le specie proteiche che si formano durante le prime fasi della conversione, possiamo proporre nuove terapie per il rilevamento della malattia prima che compaiano i sintomi”, aggiunge.
Durante lo studio, gli scienziati hanno confrontato la conversione di quattro varianti di alfa-sinucleina nel tempo, tre delle quali collegate a casi precoci della malattia e presenti in caso di invecchiamento. Quindi, hanno osservato differenze significative nei processi di aggregazione di ciascuna proteina e hanno scoperto che gli oligomeri si sviluppano molto più rapidamente nei casi di Parkinson a esordio precoce rispetto ai casi che si manifestano con l’invecchiamento. Tali risultati possono spiegare l’ insorgenza precoce dei sintomi nei pazienti con queste varianti.
Vedi anche, Marcatori genetici collegati all’ nizio dei sintomi del Parkinson.
I ricercatori hanno anche trovato prove di quali specie proteiche sono importanti per la crescita dei filamenti amiloidi. Inoltre, hanno osservato che i filamenti hanno strutture distinte a seconda della mutazione proteica da cui provengono. “La cosa più interessante è che non solo le fasi iniziali dell’associazione sono diverse, ma anche alcuni filamenti maturi di casi ereditari. Questi filamenti possono deformarsi in modo diverso a seconda della mutazione presente“, spiega Jerson Lima Silva, seconda co-autrice e Professoressa presso l’UFRJ.
Per eseguire lo studio, i ricercatori hanno utilizzato tecniche di bioimaging all’avanguardia. In primo luogo, hanno utilizzato una sonda fluorescente che ha permesso loro di visualizzare ogni passo dell’associazione proteica nel tempo. I ricercatori hanno ottimizzato le condizioni del laboratorio per rilevare strutture che non erano state precedentemente mostrate nel corso dell’associazione alfa-sinucleina. In genere, la sonda consente agli scienziati di vedere solo due fasi: buio, quando non c’è aggregazione, e luce, quando è presente aggregazione. Creando le giuste condizioni, Oliveira e Silva sono riuscite a gestire i passaggi di luminosità e, quindi, a osservare le specie intermedie partecipanti all’associazione alfa-sinucleina, che non sarebbero apparse in altre circostanze.
Anche l’uso della microscopia crioelettronica, una tecnica a cui è stato assegnato il premio Nobel 2017 per la chimica, è stato importante per lo studio. Con la visualizzazione di biomolecole a risoluzione quasi atomica, gli scienziati hanno osservato l’organizzazione strutturale dei filamenti amiloidi.
Secondo Oliveira, la possibilità di vedere tali strutture contribuisce allo sviluppo di nuovi trattamenti contro la malattia. “Immergendoci nel congelamento di questi campioni e acquisendo immagini da microscopi elettronici avanzati, siamo in grado di comprendere meglio queste associazioni proteiche errate nel loro ambiente nativo e creare i modi per evitarne la formazione. Sono lieto che il Brasile stia ora prendendo parte a questa impresa S&T”, dice Oliveira.
L’articolo “Aggregazione graduale alfa-sinucleina rivela le caratteristiche di una mutazione ad esordio precoce nella malattia di Parkinson“, è pubblicato in Communications Biology.
Fonte, Communications Biology