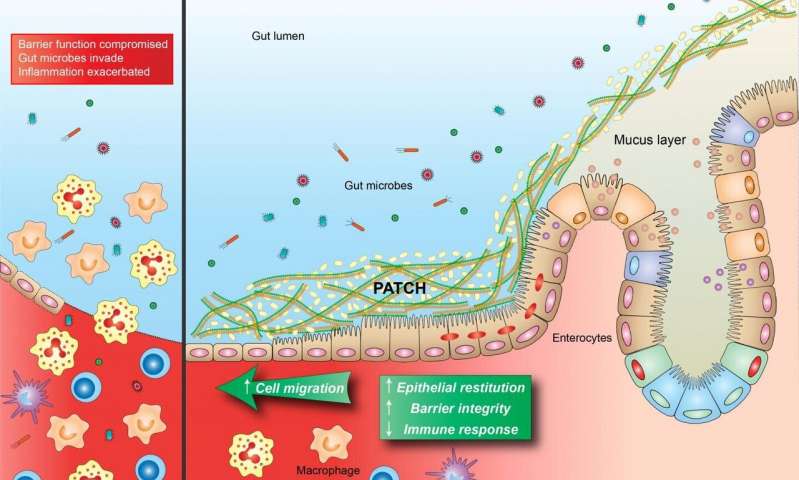
Immagine, le lesioni infiammatorie distruggono le cellule epiteliali che fungono da barriera tra l’interno dell’intestino (lume) e il resto del corpo (a sinistra). Questa perdita della funzione della barriera porta ad un ciclo di feedback di peggioramento dell’infiammazione alimentato da batteri e altre particelle che attraversano la barriera. PATCH è un materiale bioattivo sintetizzato da batteri probiotici ingegnerizzati che aiuta a mantenere la funzione della barriera intestinale anche in presenza di insulti infiammatori, contribuendo così a mantenere batteri e altri particolati nel lume e migliorando i sintomi dell’infiammazione (a destra). Credito: Wyss Institute presso l’Università di Harvard.
Circa 1,6 milioni di persone negli Stati Uniti da soli hanno attualmente una malattia infiammatoria intestinale (IBD) permanente e incurabile, compresa la malattia di Crohn e la colite ulcerosa e sempre negli Stati Uniti vengono diagnosticati 70.000 nuovi casi ogni anno.
I pazienti con IBD soffrono di dolore, disagio estremo e molti altri sintomi causati dalla recidiva e dalla remissione continue delle lesioni infiammatorie nello strato di cellule che riveste il lume intestinale (mucosa). Le cause esatte dell’IBD sono ancora poco comprese, ma è chiaro che un sistema immunitario indirizzato male è al lavoro e che alcuni componenti della comunità microbica nel nostro intestino, noto come microbioma intestinale e fattori ambientali contribuiscono alle sue forze distruttive.
Mentre i farmaci antinfiammatori possono smorzare l’infiammazione acuta e gli antibiotici possono combattere le infezioni locali quando si manifestano episodi di IBD, il loro uso ha un costo. I farmaci antinfiammatori possono avere gravi effetti collaterali e gli antibiotici possono danneggiare le parti benefiche del microbioma da cui dipendiamo per molte delle funzioni del nostro corpo. È importante sottolineare che non sono disponibili trattamenti che potrebbero essere applicati a lesioni infiammate direttamente dall’interno del lume intestinale al fine di accelerare il processo di guarigione e ridurre al minimo l’uso di tali farmaci.
Ora, un gruppo di ricerca presso il Wyss Institute for Biologically Inspired Engineering di Harvard guidato da Neel Joshi, Ph.D., ha sviluppato un approccio che utilizza un ceppo di batteri intestinali geneticamente modificati di E. coli Nissle come probiotico ad azione locale. I batteri ingegnerizzati producono una rete di nanofibre che si legano direttamente al muco per riempire aree infiammate come una patch, proteggendole da microbi intestinali e fattori ambientali. Questa strategia terapeutica a base di probiotici ha protetto i topi dagli effetti della colite indotta da un agente chimico e promosso la guarigione della mucosa.
I loro risultati dello studio sono stati riportati in Nature Communications.
“Con questo approccio di “terapia vivente”, abbiamo creato biomateriali multivalenti che vengono secreti in loco da batteri ingegnerizzati residenti e si attaccano a molte proteine del muco, aderendo saldamente allo strato viscoso”, ha detto Joshi. “L’approccio “PATCH (Probiotic Associated Therapeutic Curli Hybrids)”, come l’abbiamo chiamato, crea un rivestimento biocompatibile e mucoadesivo che funziona come un cerotto stabile autorigenerante e fornisce spunti biologici per la guarigione della mucosa“. Joshi è attualmente membro del Core Faculty del Wyss Institute e Professore associato presso la Paulson School of Engineering and Applied Sciences (SEAS) di Harvard e verrà presto nominato Professore alla Northeastern University di Boston.
In lavori precedenti, il gruppo di Joshi ha dimostrato che gli idrogel batterici autorigeneranti si attaccano saldamente alle superfici della mucosa ex vivo e, quando somministrati per via orale ai topi, hanno resistito al duro pH e alle condizioni digestive dello stomaco e dell’intestino tenue senza compromettere la salute degli animali.
Per fabbricarli, il team ha programmato un ceppo di E. coli di laboratorio per sintetizzare e secernere una proteina CsgA modificata, che come parte del sistema “curli”, (noto come fattori di adesione alla mucosa intestinale), di E. coli si assembla in lunghe nanofibre sulla superficie esterna dei batteri.
“Per consentire l’adesione del muco, abbiamo fuso CsgA nel dominio legante il muco di diversi fattori di trifoglio umano (TFF), proteine che si trovano naturalmente nella mucosa intestinale e si legano alle mucine, le principali proteine del muco presenti lì.
Vedi anche, Nuove scoperte rivelano come il microbioma cambia nell’IBD.
“La famiglia dei fattori trifoglio (TFF) umani comprende tre piccole proteine: il peptide gastrico TFF1 (pS2), il peptide spasmolitico TFF2 (SP) e il fattore trifoglio intestinale TFF3 (ITF). I fattori TFF sono proteine resistenti alle proteasi, abbondantemente secrete nel tratto gastrointestinale e coinvolte nei processi di protezione e riparazione delle mucose. Essi condividono un motivo strutturale, il dominio “trifoglio”, caratterizzato da una sequenza di circa 40 amminoacidi contenente sei residui di cisteina in grado di formare tre legami disolfuro intracatena che danno origine a tre loop da cui deriva il nome del dominio”.
“Le proteine di fusione secrete formano un rete di accumulo dell’acqua con proprietà sintonizzabili dell’idrogel “, ha detto la coautrice Anna Duraj-Thatte, Ph.D., un collega post dottorato che lavora con Joshi. “Questa si è rivelata una strategia semplice e solida per produrre materiali auto-rinnovanti, mucoadesivi con lunghi tempi di permanenza nel tratto intestinale del topo”.