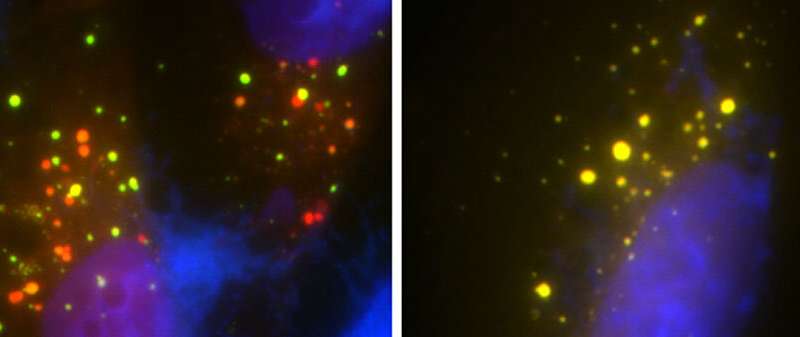
Immagine: (SLA): le cellule a sinistra hanno il normale gene UBQLN2 e i punti rossi mostrano il processo di “rimozione dei rifiuti” delle cellule in azione. Le cellule a destra hanno mutazioni genetiche che interrompono questo processo permettendo alla materia tossica di accumularsi nelle cellule. Credito: Università del Maryland School of Medicine
I ricercatori della University of Maryland School of Medicine (UMSOM) hanno identificato il modo in cui alcune mutazioni genetiche causano la sclerosi laterale amiotrofica (SLA).
Il percorso identificato dai ricercatori può anche essere responsabile di una certa forma di demenza correlata alla SLA. La scoperta potrebbe offrire potenziali nuovi approcci per il trattamento di questa condizione devastante, che provoca una paralisi progressiva, fatale e talvolta un deterioramento mentale simile alla malattia di Alzheimer.
Lo studio è stato pubblicato questa settimana negli Atti della National Academy of Sciences (PNAS) e ha incluso ricercatori dell’Università di Harvard, dell’Università di Auckland, del King’s College di Londra e della Northwestern University.
Oltre 5.000 americani vengono diagnosticati con la SLA ogni anno, una condizione che di solito è fatale e non ha cura. Circa la metà dei pazienti con SLA sviluppa anche demenza. Studi genetici su famiglie con una predisposizione allo sviluppo della SLA hanno dimostrato che la condizione può essere associata a determinate mutazioni genetiche. Alcune di queste mutazioni coinvolgono il gene UBQLN2 che regola lo smaltimento dei “rifiuti” dalle cellule del corpo. Fino ad ora, i ricercatori non hanno compreso appieno come le mutazioni di UBQLN2 interferiscono con questo percorso e causino la SLA.
“Abbiamo mappato il processo mediante il quale le mutazioni del gene ubiquilin-2 (UBQLN2) interrompono un importante percorso di riciclaggio che le cellule usano per sbarazzarsi dei loro rifiuti“, ha dichiarato Mervyn Monteiro, Ph.D., Professore di Anatomia e Neurobiologia, affiliato con il Centro UMSOM di ingegneria e tecnologia biomedica (BioMET) presso UMSOM. “Senza questo riciclaggio, le proteine mal ripiegate si accumulano nelle cellule nervose, diventano tossiche e alla fine distruggendo la cellula. Questa distruzione potrebbe portare a disturbi neurodegenerativi come la SLA”.
Vedi anche: Il microbioma intestinale influenza i risultati della SLA
Per studiare in che modo le mutazioni di UBQLN2 causano la SLA, il gruppo del Dr. Monteiro ha utilizzato sia le cellule umane sia i modelli di topo con UBQLN2 mutato, per le loro indagini. I modelli di topo, che hanno descritto in una pubblicazione su PNAS del 2016, imitano la progressione della malattia nelle persone che ereditano queste mutazioni genetiche. Il gruppo del Dr. Monteiro ha rimosso per la prima volta il gene UBQLN2 dalle cellule umane e ha scoperto che la rimozione del gene bloccava completamente il percorso di riciclaggio. Ha quindi reintrodotto nelle cellule il gene normale o il gene con una delle cinque mutazioni genetiche ed ha scoperto che la reintroduzione del normale gene UBQLN2 ha ripristinato il percorso di riciclaggio dei “rifiuti”, mentre il gene con tutte e cinque le mutazioni genetiche non è riuscito a riavviare il percorso. Utilizzando il modello murino, il Dott. Monteiro e i suoi colleghi hanno delineato il motivo dell’interruzione del percorso in presenza di mutazioni genetiche. I ricercatori hanno scoperto che i topi con le mutazioni genetiche avevano livelli ridotti di una certa proteina chiamata ATP6v1g1, che è una parte essenziale di una pompa che acidifica il contenitore di rifiuti cellulari al fine di avviare il processo di scomposizione e riciclaggio.
“I nostri nuovi risultati sono entusiasmanti perché simili difetti di acidificazione sono stati riscontrati nell’Alzheimer, nel Parkinson e nella sindrome di Down“, ha detto il Dr. Monteiro. “Ciò suggerisce che il ripristino del difetto potrebbe avere ampie implicazioni non solo nel trattamento della SLA, ma probabilmente anche di altre malattie neurodegenerative”.