Un team di scienziati dell’Istituto di fisica e tecnologia di Mosca (MIPT) e dell’Istituto di chimica bioorganica Shemyakin-Ovchinnikov (IBCh RAS) ha studiato una mutazione genetica ereditaria per scoprire meccanismi molecolari generali che possono portare sia all’inizio della malattia di Alzheimer che al forma della malattia causata da cambiamenti legati all’età nel corpo umano.
Comprendere questi meccanismi è necessario per sviluppare nuovi trattamenti mirati per questa malattia neurodegenerativa che sta diventando sempre più diffusa tra le popolazioni che invecchiano nei paesi sviluppati.
I risultati dello studio sono stati pubblicati su ACS Chemical Biology.
La demenza è una sindrome in cui vi è un deterioramento della memoria, del pensiero, del comportamento e della capacità di svolgere attività quotidiane.
La malattia di Alzheimer è la forma più comune di demenza e può contribuire al 60-70% dei casi, secondo la scheda informativa dell’OMS. Ciò rende la demenza una priorità per la salute pubblica, con ingenti fondi stanziati per combatterla da parte sia dei governi che delle aziende farmaceutiche.
La malattia di Alzheimer è più comune nelle persone di età superiore ai 65 anni, ma a volte viene diagnosticata anche a persone di età pari o inferiore a 40 anni. Circa il 10-15% dei casi a esordio precoce sono causati da predisposizione ereditaria.
La malattia di Alzheimer è associata all’accumulo di peptidi patogeni amiloidi-β nelle placche amiloidi all’interno del tessuto cerebrale. Questi peptidi sono brevi (circa 40 aminoacidi) frammenti di proteina precursore dell’amiloide (APP) che attraversa la membrana delle cellule cerebrali.
La proteina APP viene scissa da vari enzimi come parte dell’attività dei neuroni. La scissione sequenziale della “grande” proteina APP (la cui funzione biologica non è ancora del tutto chiara) da parte degli enzimi β- e γ-secretasi produce peptidi amiloidi-β che in piccole quantità sono probabilmente necessari per sostenere le funzioni cerebrali.
Tuttavia, la γ-secretasi taglia la catena APP (all’interno delle membrane dei neuroni) in frammenti consecutivi di lunghezza leggermente variabile, producendo così forme relativamente “patogene” e “non patogene” di peptidi amiloidi-β.
La forma patogena principale è costituita da 42 residui di amminoacidi (Aβ42), mentre la forma meno patogena è costituita da 40 residui (Aβ40). Il rapporto Aβ42 / Aβ40 negli esseri umani sani non è elevato, mentre un rapporto Aβ42 / Aβ40 più elevato indica una produzione eccessiva di Aβ42 che porta al disturbo neurodegenerativo.
I ricercatori stanno attualmente testando un’ipotesi secondo cui i peptidi amiloidi-β sono partecipanti attivi dell’immunità innata del sistema nervoso umano e la loro maggiore produzione può essere causata da varie infiammazioni e lesioni cerebrali.
Allo stesso tempo, molte mutazioni familiari associate all’insorgenza precoce della malattia di Alzheimer sono state trovate nel dominio transmembrana (TM) dell’APP. Allo stesso tempo, molte mutazioni familiari associate all’insorgenza precoce della malattia di Alzheimer sono state trovate nel dominio transmembrana (TM) dell’APP.
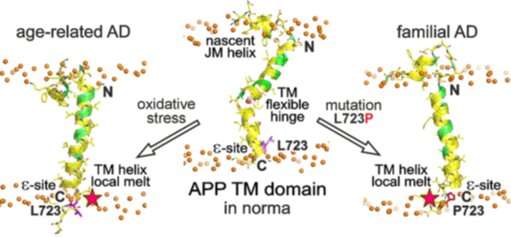
Questa ricerca mirava a studiare la mutazione familiare “australiana” (L723P) all’interno del dominio APP TM che è la causa dell’insorgenza precoce della malattia di Alzheimer. Gli scienziati hanno studiato il comportamento strutturale-dinamico del dominio mutante APP TM rispetto al tipo normale mediante l’aiuto dell’ingegneria delle proteine, della risonanza magnetica nucleare ad alta risoluzione (NMR) e simulazioni al computer.
La spettroscopia NMR è stata utilizzata per confrontare il peptide APP di tipo normale con il suo mutante mediante parametri quali “elicità” della catena polipeptidica dell’amminoacido, sua flessione e flessibilità, nonché l’accessibilità ai lipidi e alle molecole d’acqua.
I ricercatori hanno scoperto che la mutazione L723P causa la fusione locale dell’ultima curva dell’elica del dominio APP TM e inoltre raddrizza e stabilizza il dominio al centro della membrana lipidica. A parte questo, è stato notato che la mutazione aumenta l’accessibilità del dominio alle molecole di acqua, che sposta la “struttura” della sua scissione da parte della γ-secretasi, passando così tra cascate di scissione alternative (“patogene” e “non patogene”). Ciò porta ad un crescente rapporto Aβ42 / Aβ40 e alla concentrazione generale di amiloide-β all’interno del tessuto cerebrale.
Vedi anche, Una teoria alternativa spiega la causa dell’ Alzheimer.
Il ricercatore senior di ricerca del Laboratory for Aging and Age-Related Neurodegenerative Diseases, MIPT e Laboratory of biomolecular NMR-spettroscopy, IBCh RAS, Eduard Bocharov, ha commentato:
“Va da sé che questo studio affronta solo alcune delle cause del disturbo multifattoriale che è la malattia di Alzheimer. I meccanismi molecolari della sua patogenesi sono stati studiati in numerosi laboratori in tutto il mondo. In particolare, un’attenzione speciale è rivolta al “giocatore chiave”, la proteina precursore dell’amiloide, così come la sua scissione sequenziale da parte delle secretasi all’interno delle membrane dei neuroni. Abbiamo descritto una cascata di eventi che accadono all’interno e intorno alla membrana cellulare mentre l’APP viene tagliata dal complesso enzimatico γ-secretasi. Così abbiamo usato la singola mutazione “australiana” per rivelare i meccanismi molecolari alla base della patogenesi che può portare sia all’inizio precoce dell’Alzheimer che alla forma della malattia legata all’età “.
I risultati dello studio suggeriscono un meccanismo semplice della patogenesi della malattia di Alzheimer associato all’impatto della mutazione “australiana” sul comportamento strutturale-dinamico del dominio APP TM. Questo è ciò che porta alla scissione patologica dell’APP da parte delle secretasi e all’aumento dell’accumulo di patogeno amiloide-β attorno ai neuroni.
Vale la pena notare che l’insorgenza della malattia di Alzheimer correlata all’età può essere spiegata da meccanismi simili, in cui l’effetto della mutazione è sostituito dall’impatto di fattori ambientali locali, come lo stress ossidativo o la composizione lipidica della membrana inclusa la saturazione del colesterolo.
Una comprensione dettagliata dei meccanismi molecolari nella regolazione della generazione di peptidi amiloidogenici, è essenziale per lo sviluppo di nuove strategie di trattamento mirate allo stadio primario della patogenesi della malattia di Alzheimer.