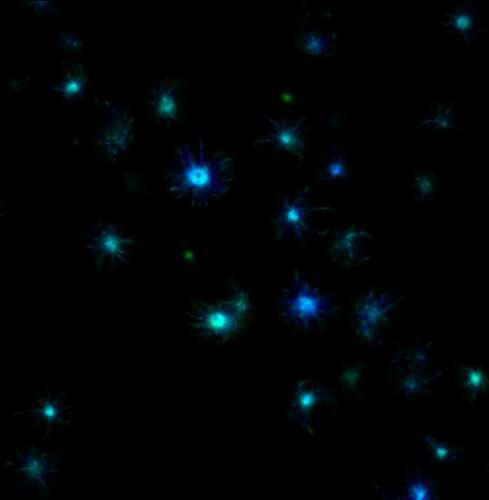
Immagine: micrografie a fluorescenza della vita di una proteina umana marcata con fluorescenza all’interno di cellule di lievito. Diversi colori indicano diversi stati di aggregazione proteica. Credito: Stowers Institute for Medical Research-
Malattie neurodegenerative devastanti come l’Huntington, l’Alzheimer e il Parkinson sono tutte associate a depositi proteici nel cervello, noti come amiloide. Nonostante gli ingenti investimenti nella ricerca sulla causa e sulla tossicità degli amiloidi, la decifrazione del primo passo nella formazione insieme a terapie efficaci è rimasta sfuggente.
Per la prima volta, gli scienziati dello Stowers Institute for Medical Research hanno scoperto la struttura del primo passaggio nella formazione dell’amiloide, chiamato nucleo, nella malattia di Huntington. Lo studio pubblicato su eLife dal ricercatore associato Randal Halfmann, Ph.D., propone un nuovo metodo radicale per il trattamento non solo dell’Huntington, ma potenzialmente di dozzine di altre malattie associate all’amiloide, prevenendo il verificarsi del passaggio iniziale che limita la frequenza.
“Questa è la prima volta che qualcuno ha determinato sperimentalmente la struttura di un nucleo amiloide, anche se la maggior parte delle principali malattie neurodegenerative sono associate agli amiloidi“, ha detto Halfmann. “Uno dei grandi misteri dell’Huntington, dell’Alzheimer e della SLA è il motivo per cui la malattia coincide con l’amiloide, ma gli stessi grumi amiloidi non sono i principali colpevoli”.
I co-primi autori Tej Kandola, Ph.D.e Shriram Venkatesan, Ph.D., hanno identificato in modo univoco la struttura del nucleo amiloide per l’huntingtina, la proteina responsabile della malattia di Huntington, scoprendo che il nucleo si forma all’interno di una singola molecola proteica.
Le proteine sono gli operai della cellula costruiti da sequenze uniche di 20 aminoacidi, i loro mattoni. Alcune proteine hanno ripetizioni di uno di questi amminoacidi: la glutammina (abbreviata in Q). La malattia di Huntington e altre otto malattie, chiamate collettivamente “malattie PolyQ”, si verificano quando alcune proteine hanno una ripetizione troppo lunga. In qualche modo, questo fa sì che le proteine si pieghino in una struttura specifica che avvia una reazione a catena che uccide la cellula.
“Da tre decenni sappiamo che la malattia di Huntington e le relative malattie mortali si verificano quando le proteine contengono più di circa 36 Q di fila, causando la formazione di catene di proteine nel cervello, ma non sapevamo perché“, ha detto Halfmann. “Ora abbiamo capito che aspetto ha il primo anello della catena e, così facendo, abbiamo scoperto un nuovo modo per fermarlo”.
“Sono, francamente, stupito che un modello fisico di nucleazione così intuitivo sia emerso nonostante la complessità intrinseca dell’ambiente cellulare“, ha affermato il professor Jeremy Schmit, Ph.D., della Kansas State University.
“Sono davvero entusiasta dell’intuizione e delle ipotesi verificabili che questo lavoro ispira”.
Un cambio di paradigma e un potenziale metodo terapeutico
Queste nuove scoperte sono potenzialmente un cambio di paradigma per come vediamo le amiloidi. I risultati di questa ricerca suggeriscono che sono le prime fasi impegnate della formazione dell’amiloide, subito dopo la formazione del nucleo, a causare la morte delle cellule neuronali.
Oltre a scoprire la struttura chiave che dà inizio alla formazione dell’amiloide poliQ, i ricercatori hanno scoperto che si forma solo in molecole isolate della proteina. L’aggregazione delle proteine nelle cellule ha impedito del tutto la formazione di amiloidi. Questa è una nuova strada terapeutica che il team intende esplorare ulteriormente nei topi e negli organoidi cerebrali.
Leggi anche:Huntington: approfondimenti sulla progressione
Una nuova tecnica
Una tecnica recentemente sviluppata dall’Halfmann Lab, Distributed Amphifluoric Förster Resonance Energy Transfer (DAmFRET), mostra come una proteina si autoassembla in singole cellule. Questo metodo si è rivelato cruciale per osservare l’evento di nucleazione che limita la velocità di formazione dell’amiloide.
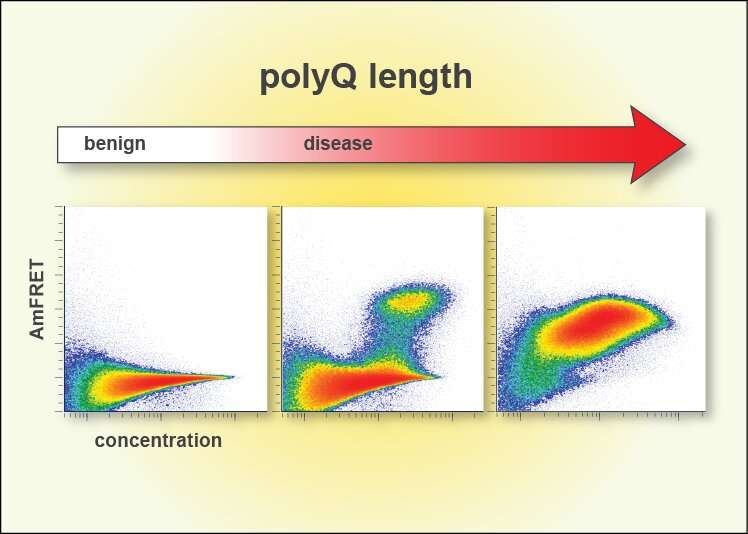
“Un’innovazione chiave è stata quella di ridurre al minimo il volume della reazione a tal punto che possiamo testimoniare la sua stocasticità, o casualità, e poi modifichiamo la sequenza per capire cosa la governa“, ha detto Halfmann.
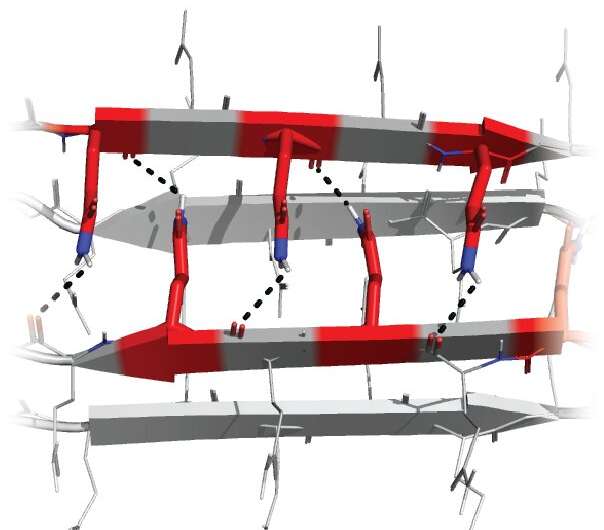
Progettare e testare modelli specifici di Q ha permesso al team di dedurre la struttura minima che potrebbe formare l’amiloide, un fascio di quattro filamenti ciascuno con tre Q in posizioni specifiche. Questo minuscolo cristallo all’interno di una singola molecola della proteina è il primo passo di una reazione a catena che provoca la malattia.
“Il lavoro precedente in provetta supporta un nucleo monomerico, ma questo modello è controverso”, ha detto Halfmann. “Ora abbiamo una forte evidenza che 36 Q è il numero critico affinché la nucleazione avvenga in singole molecole proteiche e, inoltre, che questo è il modo in cui avviene all’interno delle cellule viventi”.
In sostanza, questo lavoro fornisce un modello molecolare per studiare la struttura di qualsiasi nucleo amiloide. Inoltre, la correlazione tra invecchiamento e amiloide suggerisce che questo metodo potrebbe alla fine scoprire i meccanismi molecolari che causano l’invecchiamento.L’approccio preventivo per eliminare o almeno ritardare la nucleazione offre speranza per le persone con proteine PolyQ patologiche.
“Il paradigma emergente è che tutto segue da un singolo evento, un cambiamento spontaneo nella forma delle proteine“, ha detto Halfmann. “Quell’evento accende la reazione a catena per le amiloidi che uccidono le cellule e può fornire informazioni critiche su come le amiloidi causano la malattia“.
Fonte: eLife
